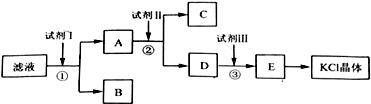
7.化学无处不在,下列与化学有关的说法正确的是( )
| A. | Si有良好的半导体性能,可直接用于制备光导纤维 | |
| B. | 淀粉、纤维素、蛋白质、油脂都是天然高分子化合物 | |
| C. | 用食醋可除去热水壶内壁的水垢 | |
| D. | Cu的金属活泼性比Fe弱,故水库铁闸门上接装铜块可减缓铁腐蚀 |
5.煤化工中两个重要反应为①C(s)+H2O(g)═H2(g)+CO(g)△H=+131.3kJ•mol-1,②CO(g)+H2O(g)$?_{△}^{催化剂}$CO2(g)+H2(g).
(1)下列说法正确的是A.
A.当反应①的容器中混合气体的密度不再变化时反应达到最大限度
B.反应②的熵变△S>0
C.反应①中增加C固体的量能增大反应速率
D.在反应中②及时分离出产生的H2对正反应速率无影响
(2)若工业上要增加反应①的速率,最经济的措施为粉碎煤炭、增加H2O的浓度、使用合适的催化剂.
(3)现将不同量的CO(g)和H2O(g)分别通入2L恒容密闭容器中进行反应,得到如表三组数据:
①实验I中,从反应开始到反应达到平衡时,H2O的平均反应速率为0.04mol/(L•min).
②CO(g)和H2O(g)反应的△H小于0 ( 填“大于”、“小于”或“等于”)
③实验III中,若平衡时,CO的转化率大于水蒸气,则a、b必须满足的关系是a<b,与实验Ⅱ相比,化学平衡常数不变(填“增大”、“减小”或“不变”).
④若在900℃时,实验II反应达到平衡后,向此容器中再加入1mol CO、0.5mol H2O、0.2mol CO2、0.5mol H2,平衡向正反应方向移动(填“正反应”、“逆反应”“不移动”).
(4)CO、H2可用于甲醇和甲醚,其反应为(m、n均大于0):
反应①:CO(g)+2H2(g)?CH3OH(g)△H=-mkJ•mol-1
反应②:2CO(g)+4H2(g)?CH3OCH3(g)+H2O(g)△H=-nkJ•mol-1
反应③:2CH3OH(g)?CH3OCH3(g)+H2O(g)△H<0
则m与n的关系为n>2m.
(1)下列说法正确的是A.
A.当反应①的容器中混合气体的密度不再变化时反应达到最大限度
B.反应②的熵变△S>0
C.反应①中增加C固体的量能增大反应速率
D.在反应中②及时分离出产生的H2对正反应速率无影响
(2)若工业上要增加反应①的速率,最经济的措施为粉碎煤炭、增加H2O的浓度、使用合适的催化剂.
(3)现将不同量的CO(g)和H2O(g)分别通入2L恒容密闭容器中进行反应,得到如表三组数据:
| 实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所 需时间/min | ||
| CO | H2O | H2 | CO2 | |||
| I | 650 | 4 | 2 | 1.6 | 1.6 | 5 |
| Ⅱ | 900 | 2 | 1 | 0.5 | 0.5 | 3 |
| Ⅲ | 900 | a | b | c | d | t |
②CO(g)和H2O(g)反应的△H小于0 ( 填“大于”、“小于”或“等于”)
③实验III中,若平衡时,CO的转化率大于水蒸气,则a、b必须满足的关系是a<b,与实验Ⅱ相比,化学平衡常数不变(填“增大”、“减小”或“不变”).
④若在900℃时,实验II反应达到平衡后,向此容器中再加入1mol CO、0.5mol H2O、0.2mol CO2、0.5mol H2,平衡向正反应方向移动(填“正反应”、“逆反应”“不移动”).
(4)CO、H2可用于甲醇和甲醚,其反应为(m、n均大于0):
反应①:CO(g)+2H2(g)?CH3OH(g)△H=-mkJ•mol-1
反应②:2CO(g)+4H2(g)?CH3OCH3(g)+H2O(g)△H=-nkJ•mol-1
反应③:2CH3OH(g)?CH3OCH3(g)+H2O(g)△H<0
则m与n的关系为n>2m.
4.原子序数依次增大的X、Y、Z、W四种短周期元素,X原子的最外层电子数与其电子层数相等,工业上一般用电解氧化物的方法得到Z的单质,W的核电荷数是Y核电荷数的2倍,X、Y两种元素可以形成原子数之比为1:1和2:1的化合物.下列说法正确的是( )
| A. | 由X、Y、Z组成的化合物既能与强碱溶液反应,又能与强酸溶液反应 | |
| B. | W的氢化物水溶液是强酸 | |
| C. | Y元素的氢化物在同周期中是最稳定的 | |
| D. | 元素Y和W只能形成一种化合物 |
3.NA表示阿伏加德罗常数的值,下列说法不正确的是( )
| A. | 5.6g铁粉与7.1g Cl2充分反应,转移电子数0.3NA | |
| B. | 1.7g羟基与1.6g甲烷分子所含电子数分别是0.9NA和NA | |
| C. | 3mol NO2与水充分反应时转移电子数2NA | |
| D. | 87g MnO2与含4NA HCl的浓盐酸加热反应,生成的氯气在标准状况下体积小于22.4L |
2.下列离子方程式正确的是( )
| A. | 向FeBr2溶液中通入少量Cl2:Cl2+2Br-═2Cl-+Br2 | |
| B. | 除去MgCl2溶液中少量的FeCl3:3Mg+2Fe3+═2Fe+3Mg2+ | |
| C. | 向含有氨水的BaCl2溶液中通入SO2:SO2+2NH3•H2O+Ba2+═BaSO3↓+2NH4++H2O | |
| D. | 将少量二氧化碳通入氯化钙溶液中:Ca2++CO2+H2O═CaCO3+2H+ |
1.化学与生产、生活、环境关系密切,下列说法正确的是( )
0 171264 171272 171278 171282 171288 171290 171294 171300 171302 171308 171314 171318 171320 171324 171330 171332 171338 171342 171344 171348 171350 171354 171356 171358 171359 171360 171362 171363 171364 171366 171368 171372 171374 171378 171380 171384 171390 171392 171398 171402 171404 171408 171414 171420 171422 171428 171432 171434 171440 171444 171450 171458 203614
| A. | 提倡使用太阳能、风能、天然气、地热能等新能源,以保护环境 | |
| B. | “玉兔号”的太阳能电池板主要由二氧化硅制成 | |
| C. | 为除去锅炉水垢中的CaSO4,可先用饱和Na2CO3溶液浸泡,再加盐酸溶解 | |
| D. | 碱性洗涤剂的去污能力比中性洗涤剂弱,是由于油脂在中性溶液中更易水解 |
 将5.3g某碱式碳酸盐固体(不含结晶水)M溶解于100g 9.8%的稀硫酸中,充分反应后得到224mL CO2(标准状况)和含有MgSO4、Al2(SO4)3的溶液.向所得溶液中逐滴加入NaOH溶液,产生沉淀的质量与加入的溶质NaOH的质量关系如图所示.
将5.3g某碱式碳酸盐固体(不含结晶水)M溶解于100g 9.8%的稀硫酸中,充分反应后得到224mL CO2(标准状况)和含有MgSO4、Al2(SO4)3的溶液.向所得溶液中逐滴加入NaOH溶液,产生沉淀的质量与加入的溶质NaOH的质量关系如图所示.