20.下列说法不正确的是( )
| A. | 推广或使用新能源汽车有助于减少氮氧化物的排放 | |
| B. | “硫黄姜”又黄又亮,可能是在用硫黄熏制过程中产生的SO2所致 | |
| C. | 华裔科学家高琨在光纤传输信息领域中取得突破性成就,光纤的主要成分是高纯度的晶体硅 | |
| D. | 原子吸收光谱仪可用于测定物质中的金属元素,红外光谱仪可用于测定化合物中的官能团 |
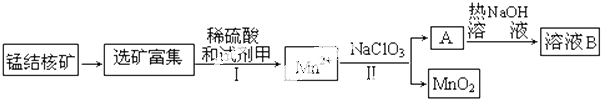
17.碱式硫酸铁[Fe(OH)SO4]是一种用于污水处理的新型高效絮凝剂,在医药上也可用于治疗消化性溃疡出血.工业上利用废铁屑(含少量氧化铝、氧化铁等)生产碱式硫酸铁的工艺流程如下:
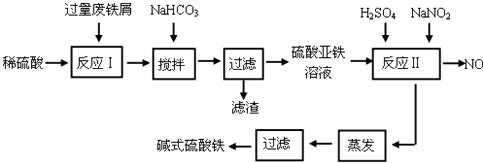
已知:部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
回答下列问题:
(1)加入少量NaHCO3的目的是调节pH在4.4~7.5范围内,使溶液中的Al3+沉淀(写离子符号).
(2)反应Ⅱ中加入NaNO2的目的是氧化Fe2+,发生反应的离子方程式为2H++Fe2++NO2-=Fe3++NO↑+H2O.
(3)在实际生产中,反应Ⅱ常同时通入O2以减少NaNO2的用量,若参与反应的O2有11.2L(标准状况),则相当于节约NaNO2的物质的量为2mol.
(4)碱式硫酸铁溶于水后产生的Fe(OH)2+离子,Fe(OH)2+可部分水解生成Fe2(OH)42+聚合离子,该水解反应的离子方程式为2Fe(OH)2++2H2O=Fe2(OH)42++2H+.

已知:部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 |
| 开始沉淀 | 2.3 | 7.5 | 3.4 |
| 完全沉淀 | 3.2 | 9.7 | 4.4 |
(1)加入少量NaHCO3的目的是调节pH在4.4~7.5范围内,使溶液中的Al3+沉淀(写离子符号).
(2)反应Ⅱ中加入NaNO2的目的是氧化Fe2+,发生反应的离子方程式为2H++Fe2++NO2-=Fe3++NO↑+H2O.
(3)在实际生产中,反应Ⅱ常同时通入O2以减少NaNO2的用量,若参与反应的O2有11.2L(标准状况),则相当于节约NaNO2的物质的量为2mol.
(4)碱式硫酸铁溶于水后产生的Fe(OH)2+离子,Fe(OH)2+可部分水解生成Fe2(OH)42+聚合离子,该水解反应的离子方程式为2Fe(OH)2++2H2O=Fe2(OH)42++2H+.
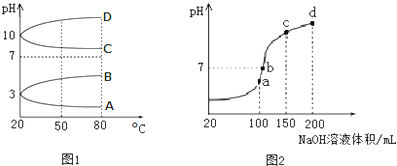
16.某溶液中可能含有H+、Na+、NH4+、Mg2+、Fe3+、Al3+、SO42-、HCO3-等离子.当向该溶液中加入一定物质的量浓度的NaOH溶液时,发现生成沉淀的物质的量随NaOH溶液的体积变化如图所示,下列说法正确的是( )
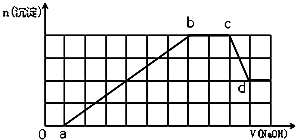

| A. | 原溶液中含有的Fe3+和Al3+的物质的量之比为1:1 | |
| B. | ab段发生的离子反应为:Al3++3OH-=Al(OH)3↓,Mg2++2OH-=Mg(OH)2↓ | |
| C. | 原溶液中含有的阳离子必定有H+、NH4+、Al3+、Mg2+ | |
| D. | d点溶液中含有的溶质只有Na2SO4 |
15.下列说法正确的是( )
| A. | CO、NO、NO2都是大气污染气体,在空气中都能稳定存在 | |
| B. | 1 mol Cu和足量稀HNO3反应产生NA个NO分子(NA为阿伏加德罗常数) | |
| C. | pH=1的溶液中,Fe2+、NO3-、SO42-、Na+不能大量共存 | |
| D. | 三氧化二铁溶于氢碘酸的离子反应为:Fe2O3+6H+=3Fe3++3H2O |
11.乙烯一种化工原料,某实验小组利用如下装置制备.发生的反应如下:CH3-CH2-OH$\stackrel{P_{2}O_{5}}{→}$CH2=CH↑+H2O
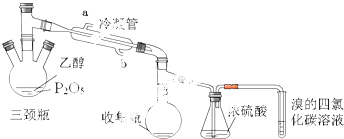
在三颈瓶中加入一定量P2O5,并注入10.0g 92%的乙醇,采用两种加热方式进行两次实验,观察现象.
回答下列问题:
(1)如图图装置中冷凝管的作用是冷凝导气,出水口为(填“a”或“b”)a,
(2)若实验中采用70℃水浴加热方式,还需要仪器有大烧杯、温度计(加热、夹持仪器、石棉网除外).
(3)浓硫酸的作用是除去乙烯中的水蒸气,三颈瓶、收集瓶中的液体经检验为磷酸三乙酯,写出三颈瓶中生成磷酸的化学方程式P2O5+3H2O=2H3PO4.
(4)已知进行两次实验,实验现象:实验1 中溴的四氯化碳溶液褪色,实验2 中溴的四氯化碳溶液不褪色.实验1使溴的四氯化碳溶液褪色的物质是乙烯,可以推断:以P2O5作为催化剂获得乙烯的反应条件是较高温度下或直接加热
(5)实验1中,溴的四氯化碳溶液增重4.48g,乙烯的产率为80%.
0 170667 170675 170681 170685 170691 170693 170697 170703 170705 170711 170717 170721 170723 170727 170733 170735 170741 170745 170747 170751 170753 170757 170759 170761 170762 170763 170765 170766 170767 170769 170771 170775 170777 170781 170783 170787 170793 170795 170801 170805 170807 170811 170817 170823 170825 170831 170835 170837 170843 170847 170853 170861 203614

在三颈瓶中加入一定量P2O5,并注入10.0g 92%的乙醇,采用两种加热方式进行两次实验,观察现象.
| 实验 | P2O5/g | 92%乙醇量/mL | 加热方式 |
| 实验1 | 2 | 4 | 酒精灯 |
| 实验2 | 2 | 4 | 水浴70℃ |
(1)如图图装置中冷凝管的作用是冷凝导气,出水口为(填“a”或“b”)a,
(2)若实验中采用70℃水浴加热方式,还需要仪器有大烧杯、温度计(加热、夹持仪器、石棉网除外).
(3)浓硫酸的作用是除去乙烯中的水蒸气,三颈瓶、收集瓶中的液体经检验为磷酸三乙酯,写出三颈瓶中生成磷酸的化学方程式P2O5+3H2O=2H3PO4.
(4)已知进行两次实验,实验现象:实验1 中溴的四氯化碳溶液褪色,实验2 中溴的四氯化碳溶液不褪色.实验1使溴的四氯化碳溶液褪色的物质是乙烯,可以推断:以P2O5作为催化剂获得乙烯的反应条件是较高温度下或直接加热
(5)实验1中,溴的四氯化碳溶液增重4.48g,乙烯的产率为80%.
 =CH-CHO有下列反应信息:
=CH-CHO有下列反应信息: +CO$→_{氯化铝}^{HCl}$
+CO$→_{氯化铝}^{HCl}$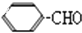
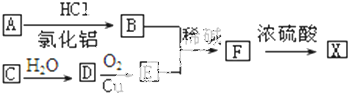
 .
. .
.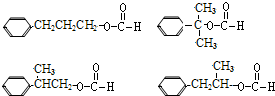 (其中之一).
(其中之一). $→_{条件1}^{G}$H$\stackrel{浓硫酸}{→}$
$→_{条件1}^{G}$H$\stackrel{浓硫酸}{→}$ =
=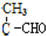 反应条件1是稀碱,试剂G是CH3CH2CHO,H的结构简式是
反应条件1是稀碱,试剂G是CH3CH2CHO,H的结构简式是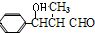 .
.