15.下列说法中正确的是( )
| A. | 短周期元素形成离子后,最外层电子达到8电子稳定结构 | |
| B. | 同一主族元素的原子,最外层电子数相同,化学性质完全相同 | |
| C. | 不同的核素,有不同的化学性质 | |
| D. | 第三周期主族元素的最高正化合价在数值上等于它所处的主族序数 |
14.下列现象中,不是因为发生化学反应而产生的是( )
| A. | 将苯滴入溴水中,振荡后水层接近无色 | |
| B. | 乙烯使酸性KMnO4溶液褪色 | |
| C. | 乙烯使溴的四氯化碳溶液褪色 | |
| D. | 甲烷与氯气混合,光照一段时间后黄绿色消失 |
13.能一次区分乙酸、乙醇、苯、溴苯四种物质的是( )
| A. | 水 | B. | 碳酸氢钠溶液 | C. | 石蕊试液 | D. | 硫酸氢钠溶液 |
12.下列有关说法正确的是( )
| A. | 改变物质的性质一定要通过化学变化 | |
| B. | 化学反应必然伴随着能量的变化 | |
| C. | 一种元素可有多种离子,但只有一种原子 | |
| D. | 放热反应一定是不需加热就能发生的 |
10.有机化合物A(C8H8O2)为一种无色液体,从A出发可发生如图的一系列反应.则下列说法正确的是( )

| A. | A的结构中含有碳碳双键 | |
| B. | G的同分异构体中属于酯且能发生银镜反应的只有一种 | |
| C. | 上述各物质中能发生水解反应的有A、B、D、G | |
| D. | 根据图示可推知D为苯酚 |
9.羟基扁桃酸是药物合成的重要中间体,它可由苯酚和乙醛酸反应制得.下列有关说法正确的是( )

| A. | 苯酚和羟基扁桃酸互为同系物 | |
| B. | 常温下,1mol羟基扁桃酸只能与1molBr2反应 | |
| C. | 此反应为加成反应,羟基扁桃酸分子中至少有12个原子共平面 | |
| D. | 乙醛酸的核磁共振氢谱中只有1个吸收峰 |
8.下列有机物相关描述不正确的是( )
| A. | 用溴水能区分乙酸、乙烯、苯、四氯化碳 | |
| B. | 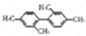 分子中至少有11个碳原子处于同一平面上 分子中至少有11个碳原子处于同一平面上 | |
| C. | 甘氨酸(H3N-CH2COOH)、丙氨酸[CH3CH(NH2)COOH]、谷氨酸[HOOC-CH2CH2CH(NH2)COOH]一定条件下形成链状三肽的结构最多有3种 | |
| D. | 1mol有机物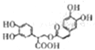 一定条件下能和6molNaOH反应 一定条件下能和6molNaOH反应 |
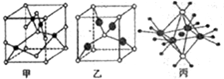
7.氮的最高价氧化物为无色晶体,它由两种离子构成,已知其阴离子构型为平面三角形,则其阳离子的构型和阳离子中氮的杂化方式为( )
| A. | 直线 sp杂化 | B. | V型 sp杂化 | ||
| C. | 三角锥形 sp2杂化 | D. | 平面三角形 sp2杂化 |
6.下列有关电子排布图的表述正确的是( )
0 170156 170164 170170 170174 170180 170182 170186 170192 170194 170200 170206 170210 170212 170216 170222 170224 170230 170234 170236 170240 170242 170246 170248 170250 170251 170252 170254 170255 170256 170258 170260 170264 170266 170270 170272 170276 170282 170284 170290 170294 170296 170300 170306 170312 170314 170320 170324 170326 170332 170336 170342 170350 203614
| A. | 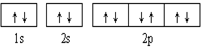 可表示单核10电子粒子基态时电子排布 可表示单核10电子粒子基态时电子排布 | |
| B. | 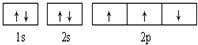 此图错误,违背了泡利原理 此图错误,违背了泡利原理 | |
| C. | 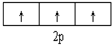 表示基态N原子的价电子排布 表示基态N原子的价电子排布 | |
| D. |  表示处于激发态的B的电子排布图 表示处于激发态的B的电子排布图 |