5.下列行为中,可行的是( )
| A. | 进入煤矿井时,用火把照明 | |
| B. | 用点燃的火柴在液化气钢瓶旁检验钢瓶是否漏气 | |
| C. | 将氧气和氢气的混合气体通过灼热的氧化铜,以除去其中的氢气 | |
| D. | 某地化工厂的贮藏罐肆意外发生泄漏,有关方面紧急组织群众沿逆风方向疏散 |
4.下列叙述中,不正确的是( )
| A. | 过滤时,漏斗下端紧贴烧杯内壁 | |
| B. | 向试管中滴加液体时,胶头滴管紧贴试管内壁 | |
| C. | 不慎将油汤洒在衣服上可用酒精、汽油等除去,它们能将油污从汤液中萃取出来而除去 | |
| D. | 玻璃是用石灰石,纯碱和二氧化硅等原料熔炼而成,在熔炼过程中发生了化学变化 |
3.向NaOH和Na2CO3混合溶液中滴加0.1mol/L盐酸,CO2的生成量与加入盐酸的体积(V)的关系如图所示,下列判断正确的是( )


| A. | 在0~a范围内,只发生中和反应 | |
| B. | ab段发生反应的离子方程式为CO32-+2H+═H2O+CO2 | |
| C. | 原混合溶液中NaOH和Na2CO3的物质的量浓度之比为2:1 | |
| D. | c点对应的溶液中还能大量存在Fe2+、NO3-离子 |
1.下列实验中操作、现象、结论对应关系正确的一组是( )
| 选 项 | 操作 | 现象 | 结论 |
| A | 向稀的苯酚水溶液中滴加浓溴水 | 生成白色沉淀 | 产物三溴苯酚不溶于水 |
| B | 淀粉和稀硫酸混合共热后,再加少量新制氢氧化铜悬浊液 | 产生红色沉淀 | 淀粉水解可生成葡萄糖 |
| C | 溴乙烷和氢氧化钠溶液充分反应后,用足量稀硝酸酸化,再加入硝酸银溶液 | 生成淡黄色沉淀 | 溴乙烷中含有溴元素 |
| D | 将溴水加入苯中并充分振荡 | 溴水褪色 | 苯与溴发生了取代反应 |
| A. | A | B. | B | C. | C | D. | D |
20.机物A的结构如图所示,下列说法正确的是( )
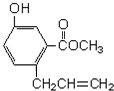

| A. | 一定条件下和浓溴水反应时,1mol A能消耗3molBr2 | |
| B. | 一定条件下,1mol A能和5mol氢气发生加成反应 | |
| C. | 一定条件下,1mol A能与3molNaOH反应 | |
| D. | A能与碳酸氢钠溶液反应 |
19.用分液漏斗可以分离的一组混合物是( )
| A. | 乙酸乙酯和乙酸 | B. | 溴苯和水 | C. | 溴乙烷和乙醇 | D. | 乙醇和水 |
18.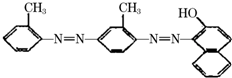 据中央电视台每周质量报告报道.北京市场上销售的一部分标称是白洋淀特产的“红心鸭蛋”含偶氮染料“苏丹红Ⅳ号”,国际癌症研究机构将其列为三类致癌物.“苏丹红Ⅳ号”的结构简式如图.下列关于“苏丹红Ⅳ号”说法正确的是( )
据中央电视台每周质量报告报道.北京市场上销售的一部分标称是白洋淀特产的“红心鸭蛋”含偶氮染料“苏丹红Ⅳ号”,国际癌症研究机构将其列为三类致癌物.“苏丹红Ⅳ号”的结构简式如图.下列关于“苏丹红Ⅳ号”说法正确的是( )
 据中央电视台每周质量报告报道.北京市场上销售的一部分标称是白洋淀特产的“红心鸭蛋”含偶氮染料“苏丹红Ⅳ号”,国际癌症研究机构将其列为三类致癌物.“苏丹红Ⅳ号”的结构简式如图.下列关于“苏丹红Ⅳ号”说法正确的是( )
据中央电视台每周质量报告报道.北京市场上销售的一部分标称是白洋淀特产的“红心鸭蛋”含偶氮染料“苏丹红Ⅳ号”,国际癌症研究机构将其列为三类致癌物.“苏丹红Ⅳ号”的结构简式如图.下列关于“苏丹红Ⅳ号”说法正确的是( )| A. | 属于芳香烃 | B. | 属于苯的同系物 | C. | 属于氨基酸 | D. | 能发生加成反应 |
17.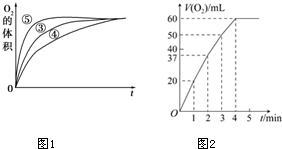 某实验小组以H2O2分解为例,研究浓度、催化剂、溶液酸碱性对反应速率的影响.在常温下按照如下方案完成实验.
某实验小组以H2O2分解为例,研究浓度、催化剂、溶液酸碱性对反应速率的影响.在常温下按照如下方案完成实验.
(1)写出实验③中H2O2分解反应方程式并标明电子转移的方向和数目: .
.
(2)实验①和②的目的是探究反应物浓度对反应速率的影响.
实验时由于没有观察到明显现象而无法得出结论.资料显示,通常条件下H2O2稳定,不易分解.为了达到实验目的,你对原实验方案的改进是向反应物中加入等量同种催化剂(或将盛有反应物的试管放在同一热水浴中).
(3)实验③、④、⑤中,测得生成氧气的体积随时间变化的关系如图1.分析上图能够得出的实验结论:碱性环境能增大H2O2分解的速率;酸性环境能减小H2O2分解速率.
(4)将0.1g MnO2粉末加入50mL H2O2溶液中,在标准状况下放出气体的体积和时间的关系如图2所示.解释反应速率变化的原因:随着反应的进行,H2O2的浓度减小,反应速率减慢,计算H2O2的初始物质的量浓度为0.11mol/L.(保留两位有效数字,在标准状况下测定)
 某实验小组以H2O2分解为例,研究浓度、催化剂、溶液酸碱性对反应速率的影响.在常温下按照如下方案完成实验.
某实验小组以H2O2分解为例,研究浓度、催化剂、溶液酸碱性对反应速率的影响.在常温下按照如下方案完成实验.| 分组实验 | 催化剂 | |
| ① | 10mL 5% H2O2溶液 | 无 |
| ② | 10mL 2% H2O2溶液 | 无 |
| ③ | 10mL 5% H2O2溶液 | 1mL 0.1mol•L-1FeCl3溶液 |
| ④ | 10mL 5%H2O2溶液+少量HCl溶液 | 1mL 0.1mol•L-1FeCl3溶液 |
| ⑤ | 10mL 5% H2O2溶液+少量NaOH溶液 | 1mL 0.1mol•L-1FeCl3溶液 |
 .
.(2)实验①和②的目的是探究反应物浓度对反应速率的影响.
实验时由于没有观察到明显现象而无法得出结论.资料显示,通常条件下H2O2稳定,不易分解.为了达到实验目的,你对原实验方案的改进是向反应物中加入等量同种催化剂(或将盛有反应物的试管放在同一热水浴中).
(3)实验③、④、⑤中,测得生成氧气的体积随时间变化的关系如图1.分析上图能够得出的实验结论:碱性环境能增大H2O2分解的速率;酸性环境能减小H2O2分解速率.
(4)将0.1g MnO2粉末加入50mL H2O2溶液中,在标准状况下放出气体的体积和时间的关系如图2所示.解释反应速率变化的原因:随着反应的进行,H2O2的浓度减小,反应速率减慢,计算H2O2的初始物质的量浓度为0.11mol/L.(保留两位有效数字,在标准状况下测定)
16.下列除去括号内杂质的有关操作中正确的是( )
0 169586 169594 169600 169604 169610 169612 169616 169622 169624 169630 169636 169640 169642 169646 169652 169654 169660 169664 169666 169670 169672 169676 169678 169680 169681 169682 169684 169685 169686 169688 169690 169694 169696 169700 169702 169706 169712 169714 169720 169724 169726 169730 169736 169742 169744 169750 169754 169756 169762 169766 169772 169780 203614
| A. | 苯(苯酚) 加浓溴水,振荡,分液 | |
| B. | 福尔马林(甲酸) 加纯碱溶液,分液 | |
| C. | 乙醇(乙酸) 加NaOH溶液,过滤 | |
| D. | 乙酸乙酯(乙酸) 加饱和Na2CO3溶液,分液 |

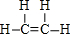 ;B的结构简式:CH3CH3;
;B的结构简式:CH3CH3;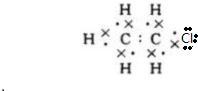 ;D的官能团名称羟基;G官能团的结构简式-COOH.
;D的官能团名称羟基;G官能团的结构简式-COOH.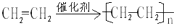 (反应类型加聚反应).
(反应类型加聚反应).