1.Cl2是一种重要的化工原料.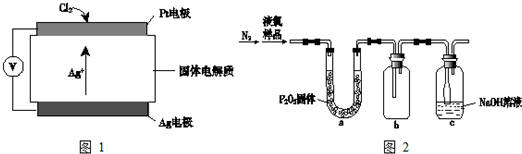
(1)电解饱和NaCl溶液获得Cl2的化学方程式是2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$Cl2↑+H2↑+OH-
(2)为便于储存,要将氯气液化[Cl2(g)?Cl2(l)],应采取的措施是加压或降温(写出一条即可).
(3)液氯储存区贴有的说明卡如下(部分):
①用离子方程式表示“泄漏处理”中NaHSO3溶液的作用HSO3-+Cl2+H2O═SO42-+3H++2Cl-
②若液氯泄漏后遇到苯,在钢瓶表面氯与苯的反应明显加快,原因是铁与氯气反应生成的氯化铁,对氯与苯的反应有催化作用
③氯气含量检测仪工作原理示意图如图1:Cl2在Pt电极放电的电极反应式是2Ag++Cl2+2e-=2AgCl↓
(4)质量标准要求液氯含水量(以1g氯气含水的质量计)<0.4mg,含水量超标会严重腐蚀钢瓶.液氯含水量的测定装置如图2所示:(已知:P2O5+3H2O═2H3PO4;Cl2与P2O5不反应.)
用离子方程式说明c装置的作用Cl2+2OH-═Cl-+ClO-+H2O.

(1)电解饱和NaCl溶液获得Cl2的化学方程式是2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$Cl2↑+H2↑+OH-
(2)为便于储存,要将氯气液化[Cl2(g)?Cl2(l)],应采取的措施是加压或降温(写出一条即可).
(3)液氯储存区贴有的说明卡如下(部分):
| 危险性 |  |
| 储运要求 | 远离金属粉末、氨、烃类、醇等物质;设置氯气检测仪 |
| 泄漏处理 | NaOH、NaHSO3溶液吸收 |
| 包装 | 钢瓶 |
②若液氯泄漏后遇到苯,在钢瓶表面氯与苯的反应明显加快,原因是铁与氯气反应生成的氯化铁,对氯与苯的反应有催化作用
③氯气含量检测仪工作原理示意图如图1:Cl2在Pt电极放电的电极反应式是2Ag++Cl2+2e-=2AgCl↓
(4)质量标准要求液氯含水量(以1g氯气含水的质量计)<0.4mg,含水量超标会严重腐蚀钢瓶.液氯含水量的测定装置如图2所示:(已知:P2O5+3H2O═2H3PO4;Cl2与P2O5不反应.)
用离子方程式说明c装置的作用Cl2+2OH-═Cl-+ClO-+H2O.
20.从如表实验事实所得出的相应结论正确的是( )
| 实验事实 | 结论 | |
| ① | 将某气体通入品红溶液中,品红溶液褪色 | 该气体一定是SO2 |
| ② | 将燃烧的镁条放入CO2中能继续燃烧 | 还原性:Mg>C |
| ③ | NaHCO3溶液与NaAlO2溶液混合产生白色沉淀 | 酸性:HCO3->Al(OH)3 |
| ④ | 常温下白磷可自燃而氮气需在放电时才与氧气反应 | 非金属性:P>N |
| ⑤ | 某白色溶液中加入氢氧化钠溶液并加热,产生的气体能使湿润红色石蕊试纸变蓝 | 该溶液中一定有NH4+ |
| A. | ①②③ | B. | ①③⑤ | C. | ②③⑤ | D. | ③④⑤ |
17. 控制适合的条件,将反应AsO43-+2I-+2H+? AsO33-+I2+H2O 设计成如图所示的原电池.下列判断正确的是( )
控制适合的条件,将反应AsO43-+2I-+2H+? AsO33-+I2+H2O 设计成如图所示的原电池.下列判断正确的是( )
 控制适合的条件,将反应AsO43-+2I-+2H+? AsO33-+I2+H2O 设计成如图所示的原电池.下列判断正确的是( )
控制适合的条件,将反应AsO43-+2I-+2H+? AsO33-+I2+H2O 设计成如图所示的原电池.下列判断正确的是( )| A. | 反应开始时,B池中石墨电极上发生氧化反应 | |
| B. | 反应开始时,A池中石墨电极上I-被还原 | |
| C. | 反应开始时,盐桥中K+由左向右迁移 | |
| D. | 电流计读数为零后,在B池中溶入Na3AsO3固体,B池中的石墨电极为正极 |
15.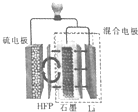 最近加拿大滑铁卢大学的科学家在锂硫(Li-S)电池技术上取得了一项重大突破,一种锂硫电池装置如图所示,其中的聚六氟丙烯(HFP)隔膜只允许Li+通过,已知放电时电池总反应为Li2S6+10Li=6Li2S,下列说法正确的是( )
最近加拿大滑铁卢大学的科学家在锂硫(Li-S)电池技术上取得了一项重大突破,一种锂硫电池装置如图所示,其中的聚六氟丙烯(HFP)隔膜只允许Li+通过,已知放电时电池总反应为Li2S6+10Li=6Li2S,下列说法正确的是( )
 最近加拿大滑铁卢大学的科学家在锂硫(Li-S)电池技术上取得了一项重大突破,一种锂硫电池装置如图所示,其中的聚六氟丙烯(HFP)隔膜只允许Li+通过,已知放电时电池总反应为Li2S6+10Li=6Li2S,下列说法正确的是( )
最近加拿大滑铁卢大学的科学家在锂硫(Li-S)电池技术上取得了一项重大突破,一种锂硫电池装置如图所示,其中的聚六氟丙烯(HFP)隔膜只允许Li+通过,已知放电时电池总反应为Li2S6+10Li=6Li2S,下列说法正确的是( )| A. | 放电时,Li+向负极移动 | |
| B. | 充电时,阳极质量减少,阴极质量增加 | |
| C. | 放电时,正极的电极反应式为S62-+10e-=6S2- | |
| D. | 可用LiCl水溶液代替HFP隔膜 |
14.已知:pAg=-lg[c(Ag-)],Kφ(AgCl)>Kφ(AgI).如图是某温度下向10mLAgNO3溶液中逐滴加入0.1mol•L-1的NaCl溶液中时,溶液的pAg随着加入NaCl溶液的体积变化的图象(曲线①).下列根据图象所得结论不正确的是(溶液混合时体积变化忽略不计)( )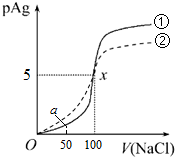

| A. | 原AgNO3溶液的物质的量浓度为1mol•L-1 | |
| B. | Kφ(AgCl)=1×10-10 | |
| C. | a点时,溶液中c(Cl-)=1.2×10-9mol•L-1 | |
| D. | 若把0.1mol•L-1的NaCl溶液换成0.1mol•L-1的NaI溶液,则pAg的变化图象变成曲线② |
13.某净水剂可用化学式W(XY)Z2表示,已知W、Z处于同一周期,W是地壳中含量最多的金属元素,XY-能抑制水的电离,工业上常用熔融的W与X形成的化合物制取W的单质,下列说法正确的是( )
| A. | 原子半径:Z>W>X>Y | |
| B. | 最高正价:Z>X>W>Y | |
| C. | W(XY)Z2既能与稀硫酸反应,又能与氢氧化钠溶液反应 | |
| D. | 向W、Z形成的化合物的水溶液中滴加氨水,先生产白色沉淀,后沉淀溶解 |
12.已知NO与H2反应后生成1molN2和水蒸气时,放出665kJ热量,其反应机理为:①2NO=N2O2(快)②N2O2+H2=N2O+H2O(慢)③N2O+H2=N2+H2O(g)(快).下列说法正确的是( )
0 167064 167072 167078 167082 167088 167090 167094 167100 167102 167108 167114 167118 167120 167124 167130 167132 167138 167142 167144 167148 167150 167154 167156 167158 167159 167160 167162 167163 167164 167166 167168 167172 167174 167178 167180 167184 167190 167192 167198 167202 167204 167208 167214 167220 167222 167228 167232 167234 167240 167244 167250 167258 203614
| A. | 整个过程的反应速率由反应②决定 | B. | N2O2,N2O是该反应的催化剂 | ||
| C. | 当$\frac{1}{2}$v(NO)=v(N2)时,反应达到平衡 | D. | 该反应的活化能为665kJ•mol-3 |

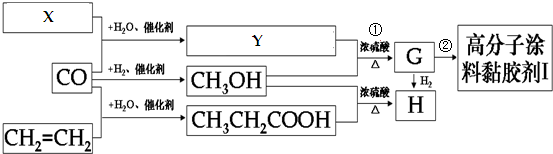
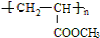

 .
. +
+ $\stackrel{H+}{?}$
$\stackrel{H+}{?}$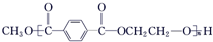 +(2n-1)CH3OH;G的同分异构体有多种,则满足下列条件的共有12种.
+(2n-1)CH3OH;G的同分异构体有多种,则满足下列条件的共有12种.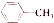 合成
合成 的流程图(写出反应物和反应条件).注:书写格式参照如下示例流程图:
的流程图(写出反应物和反应条件).注:书写格式参照如下示例流程图: