17.目前,全球有16亿人有不同程度的缺碘现象,其中包括6亿儿童.科研表明,人的一生只要能摄入一小茶匙的碘就能正常发育,健康生活.目前预防缺碘的有效办法是食用含碘食盐.这种食盐含( )
| A. | 单质碘(I2) | B. | 碘化钠中化合态的碘(I-) | ||
| C. | 碘酸钠中的碘元素 | D. | 氯化碘(ICl)中的碘元素 |
16.下列数据不合理的是( )
| A. | 用电子天平称量硫酸铜晶体的质量为2.102克 | |
| B. | 标准盐酸溶液的物质的量浓度为 0.1摩尔/升 | |
| C. | 用10毫升规格的量筒量取7.2毫升的液体 | |
| D. | 用25毫升规格的滴定管量取7.20毫升的液体 |
13.氮的化合物既是一种资源,也会给环境造成危害.
I.氨气是一种重要的化工原料.
(1)NH3与CO2在120°C,催化剂作用下反应生成尿素:CO2(g)+2NH3(g)?(NH2)2CO(s)+H2O(g),△H=-x KJ/mol (x>0),其他相关数据如表:
则表中z(用x a b d表示)的大小为x-d+b+2a.
(2)120℃时,在2L密闭反应容器中充入3mol CO2与NH3的混合气体,混合气体中NH3的体积分数随反应时间变化关系如图2所示,该反应到达平衡时CO2的平均反应速率为0.00417mol/(L•s),此温度时的平衡常数为8.

下列能使正反应的化学反应速率加快的措施有②③.
①及时分离出尿素 ②升高温度 ③向密闭定容容器中再充入CO2 ④降低温度
Ⅱ.氮的氧化物会污染环境.目前,硝酸厂尾气治理可采用NH3与于NO在催化剂存在的条件下作用,将污染物转化为无污染的物质.某研究小组拟验证NO能被氨气还原并计算其转化率(已知浓硫酸在常温下不氧化NO气体).
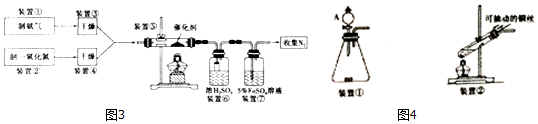
(l)写出装置⑤中反应的化学方程式4NH3+6NO$\frac{\underline{催化剂}}{△}$5N2+6H2O.
(2)装置①和装置②如图4,仪器A的名称为分液漏斗,其中盛放的药品名称为浓氨水.
装置②中,先在试管中加入2-3 粒石灰石,注入适量稀硝酸,反应一段时间后,再塞上带有细铜丝的胶塞进行后续反应,加入石灰石的作用是产生CO2,排出装置中的空气,防止NO被氧化.
(3)装置⑥中,小段玻璃管的作用是防倒吸;装置⑦的作用是除去NO,NO与FeSO4溶液反应形成棕色[Fe(NO)]SO4溶液,同时装置⑦还用来检验氨气是否除尽,若氨气未除尽,可观察到的实验现象是溶液变浑浊.
0 163964 163972 163978 163982 163988 163990 163994 164000 164002 164008 164014 164018 164020 164024 164030 164032 164038 164042 164044 164048 164050 164054 164056 164058 164059 164060 164062 164063 164064 164066 164068 164072 164074 164078 164080 164084 164090 164092 164098 164102 164104 164108 164114 164120 164122 164128 164132 164134 164140 164144 164150 164158 203614
I.氨气是一种重要的化工原料.
(1)NH3与CO2在120°C,催化剂作用下反应生成尿素:CO2(g)+2NH3(g)?(NH2)2CO(s)+H2O(g),△H=-x KJ/mol (x>0),其他相关数据如表:
| 物质 | NH3(g) | CO2(g) | CO(NH2)2(s) | H2O(g) |
| 1mol分子中的化学键断裂时需要吸收的能量/KJ | a | b | z | d |
(2)120℃时,在2L密闭反应容器中充入3mol CO2与NH3的混合气体,混合气体中NH3的体积分数随反应时间变化关系如图2所示,该反应到达平衡时CO2的平均反应速率为0.00417mol/(L•s),此温度时的平衡常数为8.

下列能使正反应的化学反应速率加快的措施有②③.
①及时分离出尿素 ②升高温度 ③向密闭定容容器中再充入CO2 ④降低温度
Ⅱ.氮的氧化物会污染环境.目前,硝酸厂尾气治理可采用NH3与于NO在催化剂存在的条件下作用,将污染物转化为无污染的物质.某研究小组拟验证NO能被氨气还原并计算其转化率(已知浓硫酸在常温下不氧化NO气体).

(l)写出装置⑤中反应的化学方程式4NH3+6NO$\frac{\underline{催化剂}}{△}$5N2+6H2O.
(2)装置①和装置②如图4,仪器A的名称为分液漏斗,其中盛放的药品名称为浓氨水.
装置②中,先在试管中加入2-3 粒石灰石,注入适量稀硝酸,反应一段时间后,再塞上带有细铜丝的胶塞进行后续反应,加入石灰石的作用是产生CO2,排出装置中的空气,防止NO被氧化.
(3)装置⑥中,小段玻璃管的作用是防倒吸;装置⑦的作用是除去NO,NO与FeSO4溶液反应形成棕色[Fe(NO)]SO4溶液,同时装置⑦还用来检验氨气是否除尽,若氨气未除尽,可观察到的实验现象是溶液变浑浊.

 ,氯化钠
,氯化钠 ,H2
,H2 .
. 某化学兴趣小组为探究元素性质的递变规律,设计了如下系列实验.
某化学兴趣小组为探究元素性质的递变规律,设计了如下系列实验. 如图所示装置中,甲、乙、丙三个烧杯依次分别盛放足量的KI溶液、足量的CuSO4溶液和K2SO4溶液,电极均为石墨电极.接通电源,经过一段时间后,测得乙中c电极质量增加32g.据此回答问题:
如图所示装置中,甲、乙、丙三个烧杯依次分别盛放足量的KI溶液、足量的CuSO4溶液和K2SO4溶液,电极均为石墨电极.接通电源,经过一段时间后,测得乙中c电极质量增加32g.据此回答问题: