10.造成空气污染的主要气体是( )
| A. | CO2 | B. | SO2 | C. | O2 | D. | N2 |
9.下列说法正确的是( )
| A. | 甲烷的标准燃烧热为△H=-890.3 kJ•mol-1,则甲烷燃烧的热化学方程式可表示为CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=-890.3 kJ•mol-1 | |
| B. | CO(g)的燃烧热是283.0 kJ•mol-1,则CO2分解的热化学方程式为:2CO2(g)═2CO(g)+O2(g)△H=+283.0 kJ•mol-1 | |
| C. | 一定条件下,将0.5 mol N2(g)和1.5 mol H2(g)置于密闭的容器中充分反应生成NH3(g),放热19.3 kJ,其热化学方程式为:N2(g)+3H2(g)?2NH3(g)△H=-38.6 kJ•mol-1 | |
| D. | 同温同压下,反应H2(g)+Cl2(g)═2HCl(g)在光照和点燃条件下的△H相同 |
8.下列各分子中所有原子都满足最外层为8电子结构的是( )
| A. | BeCl2 | B. | PCl3 | C. | PCl5 | D. | CH4 |
7. 如图是元素周期表的一部分,表格中所示元素均为前四周期的元素.X元素的非金属性在同周期中仅次于一种元素.下列说法中不正确的是( )
如图是元素周期表的一部分,表格中所示元素均为前四周期的元素.X元素的非金属性在同周期中仅次于一种元素.下列说法中不正确的是( )
 如图是元素周期表的一部分,表格中所示元素均为前四周期的元素.X元素的非金属性在同周期中仅次于一种元素.下列说法中不正确的是( )
如图是元素周期表的一部分,表格中所示元素均为前四周期的元素.X元素的非金属性在同周期中仅次于一种元素.下列说法中不正确的是( )| A. | X代表的元素处于第ⅥA族 | |
| B. | Y的最低负化合价是-3 | |
| C. | M元素的最高价氧化物对应的水化物的化学式是HMO3 | |
| D. | 气态氢化物的稳定性:N>Z |
5.今有一混合物的水溶液,只可能含有以下离子中的若干种:K+、NH4+、Ca2+、Ba2+、Cl-、CO32-、SO42-.现取三份各100mL溶液进行如下实验:
第一份加入AgNO3溶液有沉淀产生;
第二份加入足量NaOH溶液加热后,收集到气体0.04mol;
第三份加入足量BaCl2 溶液后,得沉淀6.27g,经足量盐酸洗涤后剩余沉淀质量为2.33g.
根据上述实验,以下推测正确的是( )
第一份加入AgNO3溶液有沉淀产生;
第二份加入足量NaOH溶液加热后,收集到气体0.04mol;
第三份加入足量BaCl2 溶液后,得沉淀6.27g,经足量盐酸洗涤后剩余沉淀质量为2.33g.
根据上述实验,以下推测正确的是( )
| A. | K+一定存在,且c(K+)≥0.02mol•L-1 | B. | 100mL溶液中含CO32-0.0lmol | ||
| C. | K+不一定存在 | D. | Cl-一定存在 |
3.氯化亚铜广泛应用于有机合成.工业上以低品位铜矿(主要含CuS、Fe2O3、SiO2)为原料,制备氯化亚铜的生产工艺如图:

(1)CuS中Cu的化合价为+2价.
(2)滤渣Ⅰ的成分除S之外还有SiO2,反应Ⅰ中MnO2的作用是氧化剂
(3)已知生成氢氧化物的pH如表一:
表一:
则反应Ⅱ中用氨水调节pH值的范围是3.2≤PH<4.2.
(4)检验滤液Ⅱ中是否含有Fe3+的试剂是KSCN溶液.
(5)请用化学用语回答:
①反应Ⅲ中生成难溶MnCO3的离子方程式Mn2++HCO3-+NH3=MnCO3↓+NH4+;
②反应Ⅳ所所对应的化学方程式Cu(NH3)4CO3+6HCl+Cu=2CuCl↓+4NH4Cl+CO2↑+H2O.
(6)氯化亚铜的定量分析:
步骤Ⅰ.称取0.2500g的样品和10.0mL 1.0mol/L的FeCl3溶液置于250mL锥形瓶中,不断摇动;
步骤Ⅱ.待样品溶解后,加水10.0mL和3滴指示剂;
步骤Ⅲ.用0.1000mol/L CeOSO4标准溶液滴至终点,并记录读数.重复实验两次,测得数据如表二:
表二:
已知:CuCl+FeCl3═CuCl2+FeCl2 Fe2++Ce4+═Fe3++Ce3+
①数据处理:计算CuCl纯度79.6%;
②误差分析:下列操作会使滴定结果偏高的是BCD.
A.锥形瓶中有少量蒸馏水
B.滴定终点读数时仰视滴定管刻度线,其他操作正确
C.0.1000mol/L CeOSO4溶液久置后浓度变小
D.滴定前滴定管尖嘴有气泡,滴定后气泡消失
E.所取FeCl3溶液体积偏大.

(1)CuS中Cu的化合价为+2价.
(2)滤渣Ⅰ的成分除S之外还有SiO2,反应Ⅰ中MnO2的作用是氧化剂
(3)已知生成氢氧化物的pH如表一:
表一:
| 沉淀物 | Fe(OH)3 | Mn(OH)2 | Cu(OH)2 |
| 开始沉淀的pH | 2.7 | 8.3 | 4.2 |
| 完全沉淀的pH | 3.2 | 9.8 | 6.7 |
(4)检验滤液Ⅱ中是否含有Fe3+的试剂是KSCN溶液.
(5)请用化学用语回答:
①反应Ⅲ中生成难溶MnCO3的离子方程式Mn2++HCO3-+NH3=MnCO3↓+NH4+;
②反应Ⅳ所所对应的化学方程式Cu(NH3)4CO3+6HCl+Cu=2CuCl↓+4NH4Cl+CO2↑+H2O.
(6)氯化亚铜的定量分析:
步骤Ⅰ.称取0.2500g的样品和10.0mL 1.0mol/L的FeCl3溶液置于250mL锥形瓶中,不断摇动;
步骤Ⅱ.待样品溶解后,加水10.0mL和3滴指示剂;
步骤Ⅲ.用0.1000mol/L CeOSO4标准溶液滴至终点,并记录读数.重复实验两次,测得数据如表二:
表二:
| 序号 | 1 | 2 | 3 |
| 起始读数 | 0.95mL | 0.70mL | 1.00mL |
| 终点读数 | 20.95mL | 24.95mL | 21.00mL |
①数据处理:计算CuCl纯度79.6%;
②误差分析:下列操作会使滴定结果偏高的是BCD.
A.锥形瓶中有少量蒸馏水
B.滴定终点读数时仰视滴定管刻度线,其他操作正确
C.0.1000mol/L CeOSO4溶液久置后浓度变小
D.滴定前滴定管尖嘴有气泡,滴定后气泡消失
E.所取FeCl3溶液体积偏大.
2.二氯化碳利用具有十分重要的意义,科学家有以下几个设想.
(1)用太阳能将CO2转化成O2和C(石墨烯),其设想如图1:
①Fe3O4中Fe的化合价是+2和+3;
②重整系统发生反应的化学方程式为6FeO+CO2═2Fe3O4+C.
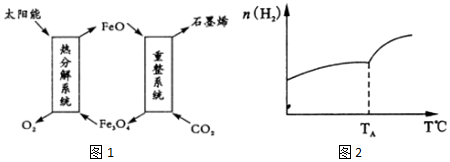
(2)二氧化碳和氢气在催化剂作用下可制取低碳烯烃.在一密闭容器中分别投入1molCO2、3molH2,发生反应:2CO2(g)+6H2(g)?C2H4 (g)+4H2O(g)△H;在不同温度下,用传感技术测出平衡时H2的物质的量变化关系如图2所示.
①其它条件不变,起始时若按lmolCO2、2molH2进行投料,CO2转化率将减小(填“增大”、“减小”或“不变”);
②△H<0(填“>”“<”“不能确定”).
③若测试中体系内无氧气产生,试结合图示推断热稳定性C2H4<H2O (填“>”“<”“不能确定”).
(3)用氨水吸收CO2制化肥(NH4HCO3)
①已知:NH3•H2O(aq)?NH4+(aq)+OH-(aq)△H1=a kJ•mol-1
CO2 (g)+H2O(l)?H2CO3 (aq)△H2=bkJ•mol-1
H2CO3(aq)+OH-(aq)?HCO3-(aq)+H2O(l)△H3=ckJ•mol-1
则利用NH3•H2O吸收CO2制备NH4HCO3的热化学方程式为NH3•H2O+CO2═NH4++HCO3-△H=(a+b+c)kJ/mol;
②已知常温下相关数据如表:
则反应NH4++HCO3-+H2O?NH3•H2O+H2CO3的平衡常数k=1.25×10-3.
0 163804 163812 163818 163822 163828 163830 163834 163840 163842 163848 163854 163858 163860 163864 163870 163872 163878 163882 163884 163888 163890 163894 163896 163898 163899 163900 163902 163903 163904 163906 163908 163912 163914 163918 163920 163924 163930 163932 163938 163942 163944 163948 163954 163960 163962 163968 163972 163974 163980 163984 163990 163998 203614
(1)用太阳能将CO2转化成O2和C(石墨烯),其设想如图1:
①Fe3O4中Fe的化合价是+2和+3;
②重整系统发生反应的化学方程式为6FeO+CO2═2Fe3O4+C.

(2)二氧化碳和氢气在催化剂作用下可制取低碳烯烃.在一密闭容器中分别投入1molCO2、3molH2,发生反应:2CO2(g)+6H2(g)?C2H4 (g)+4H2O(g)△H;在不同温度下,用传感技术测出平衡时H2的物质的量变化关系如图2所示.
①其它条件不变,起始时若按lmolCO2、2molH2进行投料,CO2转化率将减小(填“增大”、“减小”或“不变”);
②△H<0(填“>”“<”“不能确定”).
③若测试中体系内无氧气产生,试结合图示推断热稳定性C2H4<H2O (填“>”“<”“不能确定”).
(3)用氨水吸收CO2制化肥(NH4HCO3)
①已知:NH3•H2O(aq)?NH4+(aq)+OH-(aq)△H1=a kJ•mol-1
CO2 (g)+H2O(l)?H2CO3 (aq)△H2=bkJ•mol-1
H2CO3(aq)+OH-(aq)?HCO3-(aq)+H2O(l)△H3=ckJ•mol-1
则利用NH3•H2O吸收CO2制备NH4HCO3的热化学方程式为NH3•H2O+CO2═NH4++HCO3-△H=(a+b+c)kJ/mol;
②已知常温下相关数据如表:
| Kb(NH3•H2O) | 2×10-5mol•L-1 |
| Ka1(H2CO3) | 4×10-7mol•L-1 |
| Ka2(H2CO3) | 4×10-11mol•L-1 |
