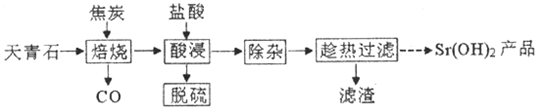
7.锶有“金属味精”之称.以天青石(主要含有SrSO4和少量CaCO3、MgO杂质)生产氢氧化锶的工艺如图:
已知氢氧化锶在水中的溶解度:
(1)若隔绝空气焙烧时SrSO4只被还原成SrS,写出焙烧时的化学反应方程式SrSO4+4C$\frac{\underline{\;高温\;}}{\;}$SrS+4CO↑
(2)“除杂”方法:将溶液升温至95℃,加NaoH溶液调节pH为12.
①95℃时水的离子积Kw=1.0×10-12,Ksp[mg (OH)2]=1.2×10-10则溶液中c(Mg2+)=1.2×10-10mol•L-1
②若PH过大,将导致氢氧化锶的产率降低,请解释原因OH-对氢氧化锶的溶解起抑制作用,OH-浓度过大,将使氢氧化锶沉淀析出
(3)‘趁热过滤”的目的是防止温度降低使氢氧化锶析出而造成损失,“滤渣”的主要成分为Ca(OH)2、Mg(OH)2
(4)从趁热过滤后的滤液中得到Sr(OH)2产品的步骤为降温结晶、过滤、洗涤、干燥.
(5)“脱硫”方法:用FeCl3溶液吸收酸浸产生的气体,吸收时发生反应的化学方程式为2FeCl3+H2S=2FeCl2+S↓+2HCl.

已知氢氧化锶在水中的溶解度:
| 温度(℃) | 0 | 10 | 20 | 30 | 40 | 60 | 80 | 90 | 100 |
| 溶液度(g/100ml) | 0.91 | 1.25 | 1.77 | 2.64 | 3.95 | 8.42 | 20.2 | 44.5 | 91.2 |
(2)“除杂”方法:将溶液升温至95℃,加NaoH溶液调节pH为12.
①95℃时水的离子积Kw=1.0×10-12,Ksp[mg (OH)2]=1.2×10-10则溶液中c(Mg2+)=1.2×10-10mol•L-1
②若PH过大,将导致氢氧化锶的产率降低,请解释原因OH-对氢氧化锶的溶解起抑制作用,OH-浓度过大,将使氢氧化锶沉淀析出
(3)‘趁热过滤”的目的是防止温度降低使氢氧化锶析出而造成损失,“滤渣”的主要成分为Ca(OH)2、Mg(OH)2
(4)从趁热过滤后的滤液中得到Sr(OH)2产品的步骤为降温结晶、过滤、洗涤、干燥.
(5)“脱硫”方法:用FeCl3溶液吸收酸浸产生的气体,吸收时发生反应的化学方程式为2FeCl3+H2S=2FeCl2+S↓+2HCl.
6.下列热化学方程式中,书写正确的是( )
| A. | 2SO2+O2?2SO3△H=-196.6 kJ•mol-1 | |
| B. | H2(g)+$\frac{1}{2}$O2(g)═H2O(l)△H=-285.8 kJ•mol-1 | |
| C. | 2H2(g)+O2(g)═2H2O(l)△H=-571.6 kJ | |
| D. | C(s)+O2(g)═CO2(g)△H=393.5 kJ•mol-1 |
5.下列实验操作或事故处理中,做法正确的是( )
| A. | 用稀硫酸清洗做焰色反应的铂丝 | |
| B. | 新配硫酸铁溶液要加入铁钉和稀硫酸保存 | |
| C. | 用剩的金属钠要放回原试剂瓶中,不能随意丢弃 | |
| D. | 大量金属钠着火可以用干粉(含NaHCO3)灭火器灭火 |
4.下列说法正确的是( )
| A. | Na与氧气反应因氧气用量不同,产物不同 | |
| B. | Na2O和Na2O2中阳阴离子物质的量之比均为2:1 | |
| C. | Na2CO3和NaHCO3的水溶液都呈碱性,它们都属于碱 | |
| D. | Na2O和Na2O2都能与水反应生成对应的碱,它们都属于碱性氧化物 |
3.某学生的实验报告所列出的下列数据中合理的是( )
| A. | 用10mL量筒量取7.13mL稀盐酸 | |
| B. | 用pH试纸测得某稀盐酸的pH为1.5 | |
| C. | 用碱式滴定管量取20.3 mL烧碱溶液 | |
| D. | 用托盘天平称得某物质的质量为13.1g |
2.下列有关概念的说法中不正确的是( )
| A. | 增大反应物浓度可以增大单位体积内活化分子数,但活化分子百分数不变,从而使反应速率增大 | |
| B. | 在化学反应中,能量较高、能发生碰撞的分子称为活化分子 | |
| C. | 汽车尾气的催化转化装置可将尾气中的NO和CO等有害气体快速地转化为N2和CO2,其原因是催化剂可降低NO和CO反应的活化能 | |
| D. | 溶液中的离子反应瞬间发生,其反应的活化能接近为零 |
1.下列说法或表示法正确的是( )
| A. | 由“C(s,石墨)→C(s,金刚石)△H=+119kJ•mol-1”可知金刚石比石墨稳定 | |
| B. | 在101kPa时,2gH2完全燃烧生成液态水,放出285.8kJ热量,则氢气燃烧的热化学方程式表示为:2H2(g)+O2(g)=2H2O (1)△H=-285.8kJ•mol-1 | |
| C. | 在101kPa时,1mol碳燃烧所放出的热量为碳的燃烧热 | |
| D. | 等量的磷蒸气和磷固体分别完全燃烧,前者放出的热量多 |
20.下列反应的反应热△H>0的是( )
| A. | 铝与稀硫酸反应 | B. | 加热氧化银冶炼银 | ||
| C. | 醋酸与氨水反应 | D. | 液化石油气燃烧 |
19.如图为周期表前四周期的一部分,关于X、Y、Z、M的说法正确的是( )


| A. | X、Y形成的简单离子的最外层电子均满足8e-稳定结构 | |
| B. | M的最外层电子数比Z大10 | |
| C. | X、M的气态氢化物的稳定性M>X | |
| D. | Y、Z的最高价氧化物的水化物酸性为Y<Z |
18.一定温度下容积不变的容器中发生可逆反应A2(s)+2B2(g)?2AB2(g),达到平衡的标志是( )
0 163783 163791 163797 163801 163807 163809 163813 163819 163821 163827 163833 163837 163839 163843 163849 163851 163857 163861 163863 163867 163869 163873 163875 163877 163878 163879 163881 163882 163883 163885 163887 163891 163893 163897 163899 163903 163909 163911 163917 163921 163923 163927 163933 163939 163941 163947 163951 163953 163959 163963 163969 163977 203614
| A. | 容器内每减少1mol A2,同时生成2mol AB2 | |
| B. | 容器内每减少1mol A2,同时消耗2mol B2 | |
| C. | 密闭容器内混合气体总压强不随时间变化 | |
| D. | 密闭容器内的气体密度不随时间变化 |