题目内容
2.下列有关概念的说法中不正确的是( )| A. | 增大反应物浓度可以增大单位体积内活化分子数,但活化分子百分数不变,从而使反应速率增大 | |
| B. | 在化学反应中,能量较高、能发生碰撞的分子称为活化分子 | |
| C. | 汽车尾气的催化转化装置可将尾气中的NO和CO等有害气体快速地转化为N2和CO2,其原因是催化剂可降低NO和CO反应的活化能 | |
| D. | 溶液中的离子反应瞬间发生,其反应的活化能接近为零 |
分析 增大浓度、压强,活化分子的浓度增大,但百分数不变,升高温度、加入催化剂,可增大活化分子的百分数,以此解答该题.
解答 解:A.增大反应物浓度,活化分子浓度增大,但百分数不变,故A正确;
B.能发生碰撞且发生化学反应的分子为活化分子,故B错误;
C.催化剂可降低NO和CO反应的活化能,加快反应速率,将尾气中的NO和CO等有害气体快速地转化为N2和CO2,故C正确;
D.为离子反应,反应容易进行,且反应速率大,则反应的活化能几乎为零,故D正确.
故选B.
点评 本题考查影响反应速率的因素以及反应热与焓变,为高频考点,把握浓度、温度、压强、催化剂对反应速率的影响即可解答,侧重活化理论的理解及分析的考查,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
12.下列说法正确的是( )
| A. | 凡能起银镜反应的物质一定是醛 | |
| B. | 油脂、淀粉和蛋白质均属于高分子化合物 | |
| C. | 向经唾液充分作用后的苹果中滴入碘水鉴定淀粉是否水解完全 | |
| D. | 在加热和有催化剂的条件下,醇都能被空气中的O2所氧化,生成对应的醛 |
13.不能够区分碳酸钠和碳酸氢钠固体的方法是( )
| A. | 加热 | |
| B. | 与等体积等浓度盐酸反应的剧烈程度 | |
| C. | 与氯化钙溶液反应的现象 | |
| D. | 与澄清石灰水的反应现象 |
10.下列变化中,一定需加还原剂才能实现的是 ( )
| A. | Cl2→Cl- | B. | FeCl3→FeCl2 | C. | C→CO2 | D. | KMnO4→MnO2 |
17.已知热化学方程式:SO2(g)+0.5O2(g)?SO3(g)△H=-98.32kJ/mol,在容器中充入2molSO2和1molO2充分反应,最终放出的热量为( )
| A. | 196.64kJ | B. | 196.64kJ/mol | C. | <196.64kJ | D. | >196.64kJ |
7.锶有“金属味精”之称.以天青石(主要含有SrSO4和少量CaCO3、MgO杂质)生产氢氧化锶的工艺如图:
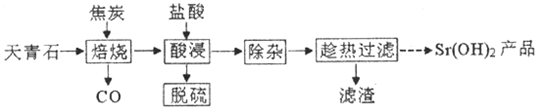
已知氢氧化锶在水中的溶解度:
(1)若隔绝空气焙烧时SrSO4只被还原成SrS,写出焙烧时的化学反应方程式SrSO4+4C$\frac{\underline{\;高温\;}}{\;}$SrS+4CO↑
(2)“除杂”方法:将溶液升温至95℃,加NaoH溶液调节pH为12.
①95℃时水的离子积Kw=1.0×10-12,Ksp[mg (OH)2]=1.2×10-10则溶液中c(Mg2+)=1.2×10-10mol•L-1
②若PH过大,将导致氢氧化锶的产率降低,请解释原因OH-对氢氧化锶的溶解起抑制作用,OH-浓度过大,将使氢氧化锶沉淀析出
(3)‘趁热过滤”的目的是防止温度降低使氢氧化锶析出而造成损失,“滤渣”的主要成分为Ca(OH)2、Mg(OH)2
(4)从趁热过滤后的滤液中得到Sr(OH)2产品的步骤为降温结晶、过滤、洗涤、干燥.
(5)“脱硫”方法:用FeCl3溶液吸收酸浸产生的气体,吸收时发生反应的化学方程式为2FeCl3+H2S=2FeCl2+S↓+2HCl.

已知氢氧化锶在水中的溶解度:
| 温度(℃) | 0 | 10 | 20 | 30 | 40 | 60 | 80 | 90 | 100 |
| 溶液度(g/100ml) | 0.91 | 1.25 | 1.77 | 2.64 | 3.95 | 8.42 | 20.2 | 44.5 | 91.2 |
(2)“除杂”方法:将溶液升温至95℃,加NaoH溶液调节pH为12.
①95℃时水的离子积Kw=1.0×10-12,Ksp[mg (OH)2]=1.2×10-10则溶液中c(Mg2+)=1.2×10-10mol•L-1
②若PH过大,将导致氢氧化锶的产率降低,请解释原因OH-对氢氧化锶的溶解起抑制作用,OH-浓度过大,将使氢氧化锶沉淀析出
(3)‘趁热过滤”的目的是防止温度降低使氢氧化锶析出而造成损失,“滤渣”的主要成分为Ca(OH)2、Mg(OH)2
(4)从趁热过滤后的滤液中得到Sr(OH)2产品的步骤为降温结晶、过滤、洗涤、干燥.
(5)“脱硫”方法:用FeCl3溶液吸收酸浸产生的气体,吸收时发生反应的化学方程式为2FeCl3+H2S=2FeCl2+S↓+2HCl.
14.下列各组物质的性质比较中,正确的是( )
| A. | 热稳定性:PH3<SiH4<NH3<HF | |
| B. | 微粒直径大小:S2->Cl->Mg2+>Na+ | |
| C. | 酸性强弱:HClO<H2CO3<H2SO3<HBrO4 | |
| D. | 熔点高低:石墨>食盐>干冰>液溴 |
3.设NA为阿伏加德罗常数,下列有关叙述不正确的是( )
| A. | 标准状况下,1L庚烷完全燃烧所生成的气态产物的分子数为($\frac{7}{22.4}$)NA | |
| B. | 1 mol甲基(-CH3)所含的电子总数为9NA | |
| C. | 0.5 mol 1,3-丁二烯分子中含有π键数为NA | |
| D. | 1 mol乙酸所含的电子总数为32NA |
4.取一定质量的均匀固体混合物Cu、CuO和Cu2O,将其分成两等份,取其中一份用足量的氢气还原,测得反应后固体质量减少3.20g,另一份中加入500mL稀硝酸(其还原产物为NO),固体恰好完全溶解,且同时收集到标准状况下NO气体4.48L,则所用硝酸的物质的量浓度为( )
| A. | 2.0 mol/L | B. | 2.4 mol/L | C. | 1.2 mol/L | D. | 1.0mol/L |