18.KClO3是一种常见的氧化剂,常用于医药工业、印染工业和制造烟火.实验室用KClO3和MnO2混合加热制氧气,现取KClO3和MnO2的混合物16.60g加热至恒重,将反应后的固体加15g水充分溶解,剩余固体6.55g (25℃),再加5g水充分溶解,仍剩余固体4.80g(25℃).
(1)若剩余的4.80g固体全是MnO2,则原混合物中KClO3的质量为11.80g;
(2)若剩余的4.80g固体是MnO2和KCl的混合物
①则25℃时KCl的溶解度为35g/100g水;
②原混合物中KClO3的质量为12.25g;
(3)MnO2是一种典型的强氧化剂,无论在实验室还是在化工生产中都有重要的应用.如下图是实验室制备氯气并进行一系列相关实验的装置(夹持设备和加热装置已略).

①制备氯气选用的药品为MnO2和浓盐酸,相应的离子方程式为MnO2+4H++2Cl-═Mn2++Cl2↑+2H2O.
②装置B的作用是除杂和安全瓶.实验进行时C中可能发生堵塞,请写出发生堵塞时B中的现象:锥形瓶中的液面下降,长颈漏斗中的液面上升.
③装置C的实验目的是验证氯气是否具有漂白性,为此C中Ⅰ、Ⅱ、Ⅲ依次放入c(选“a”“b”或“c”).
④设计装置D、E的目的是比较氯、溴、碘的非金属性.当向D中缓缓通入足量氯气时,可以看到无色溶液逐渐变为红棕色,说明氯的非金属性大于溴.打开活塞,将D中的少量溶液加入E中,振荡E,观察到的现象是E中溶液分为两层,上层(苯层)为紫红色.该现象不能(填“能”或“不能”)说明溴的非金属性强于碘,原因是过量的Cl2也可将I-氧化为I2.
(1)若剩余的4.80g固体全是MnO2,则原混合物中KClO3的质量为11.80g;
(2)若剩余的4.80g固体是MnO2和KCl的混合物
①则25℃时KCl的溶解度为35g/100g水;
②原混合物中KClO3的质量为12.25g;
(3)MnO2是一种典型的强氧化剂,无论在实验室还是在化工生产中都有重要的应用.如下图是实验室制备氯气并进行一系列相关实验的装置(夹持设备和加热装置已略).

①制备氯气选用的药品为MnO2和浓盐酸,相应的离子方程式为MnO2+4H++2Cl-═Mn2++Cl2↑+2H2O.
②装置B的作用是除杂和安全瓶.实验进行时C中可能发生堵塞,请写出发生堵塞时B中的现象:锥形瓶中的液面下降,长颈漏斗中的液面上升.
③装置C的实验目的是验证氯气是否具有漂白性,为此C中Ⅰ、Ⅱ、Ⅲ依次放入c(选“a”“b”或“c”).
| a | b | c | |
| Ⅰ | 干燥的有色布条 | 湿润的有色布条 | 湿润的有色布条 |
| Ⅱ | 碱石灰 | 浓硫酸 | 无水氯化钙 |
| Ⅲ | 湿润的有色布条 | 干燥的有色布条 | 干燥的有色布条 |
17.有机物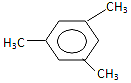 用系统命名法命名的名称为( )
用系统命名法命名的名称为( )
 用系统命名法命名的名称为( )
用系统命名法命名的名称为( )| A. | 间三甲苯 | B. | 1,3,5-三甲苯 | C. | 三甲苯 | D. | 1-3-5,三甲苯 |
16.下列物质与水混合后静置,不出现分层的是( )
| A. | 乙醇 | B. | 苯 | C. | 三氯甲烷 | D. | 四氯化碳 |
15.下列有关能量转化的认识不正确的是( )
| A. | 燃料燃烧,只是将化学能转化为了热能 | |
| B. | 人类使用照明设备,将电能转化为光能 | |
| C. | 生物体内的化学变化过程在能量转化上比在体外发生的一些能量转化更为合理有效 | |
| D. | 通过植物的光合作用,太阳能转化为化学能 |
14.下列说法正确的是( )
| A. | 化学键的断裂过程中放出热量 | B. | 原电池的负极发生氧化反应 | ||
| C. | 原电池的正极发生氧化反应 | D. | 化学键形成的过程需要吸收热量 |
13.下列说法错误的是( )
| A. | 溶于水能导电的化合物一定是离子化合物 | |
| B. | 在共价化合物中一定含有共价键 | |
| C. | 含有共价键的化合物不一定是共价化合物 | |
| D. | 离子化合物中不一定都含有金属元素 |
12.下列事实与氢键有关的是( )
| A. | HF、HCl、HBr、HI的热稳定性依次减弱 | |
| B. | 水加热到很高的温度都难以分解 | |
| C. | CH4、SiH4、GeH4、SnH4熔点随相对分子质量增大而升高 | |
| D. | 水结成冰体积膨胀 |
11.下列说法正确的是( )
| A. | 可以通过电解熔融AlCl3来冶炼铝 | |
| B. | HF的稳定性很强,是因为其分子间能形成氢键 | |
| C. | 非极性键不只存在于双原子单质分子中 | |
| D. | 分解反应都是吸热反应,化合反应都是放热反应 |
10.用NA表示阿伏加德罗常数的值,下列说法均不正确的是( )
①将1mol氯气通入一定量水中发生反应转移电子数为NA
②12.0g熔融的NaHSO4中含有的阳离子数为0.1NA
③在标准状况下,22.4L辛烷中的分子数为NA
④1mol羟基中含有的电子数为10NA
⑤1mol Na2O和Na2O2混合物中含有的阴、阳离子总数是3NA.
①将1mol氯气通入一定量水中发生反应转移电子数为NA
②12.0g熔融的NaHSO4中含有的阳离子数为0.1NA
③在标准状况下,22.4L辛烷中的分子数为NA
④1mol羟基中含有的电子数为10NA
⑤1mol Na2O和Na2O2混合物中含有的阴、阳离子总数是3NA.
| A. | ②③⑤ | B. | ①②④ | C. | ①③④ | D. | ③④⑤ |
9.下列各组物质中,互称为同分异构体的是( )
0 163609 163617 163623 163627 163633 163635 163639 163645 163647 163653 163659 163663 163665 163669 163675 163677 163683 163687 163689 163693 163695 163699 163701 163703 163704 163705 163707 163708 163709 163711 163713 163717 163719 163723 163725 163729 163735 163737 163743 163747 163749 163753 163759 163765 163767 163773 163777 163779 163785 163789 163795 163803 203614
| A. | 水与冰 | B. | O2与O3 | C. | 正丁烷和异丁烷 | D. | 氕和氚 |