15.NH3和纯净的O2在一定条件下发生反应:4NH3(g)+3O2(g)?2N2(g)+6H2O(g),现向一容积不变的2L密闭容器中充入4mol NH3和 3mol O2,4min后达到平衡,测得生成的H2O(g)占混合气体体积的40%,则下列说法不正确的是(假设反应前后温度保持不变)( )
| A. | 平衡时压强是起始压强的$\frac{15}{14}$倍 | B. | 平衡时NH3的浓度为1 mol/L | ||
| C. | 该过程中v(O2)=0.225 mol/(L•min) | D. | 达平衡时消耗O2 1.5 mol |
14.α-氯乙基苯是一种重要的有机合成中间体,其一种制备反应原理为:
 (g)+Cl2(g)?
(g)+Cl2(g)? (g)+HCl(g)△H
(g)+HCl(g)△H
在T℃时,向2.0L恒容密闭容器中充入0.40mol乙苯(g)和0.40mol Cl2(g)进行反应,反应过程中测定的部分数据见表:
下列有关说法正确的是( )
 (g)+Cl2(g)?
(g)+Cl2(g)? (g)+HCl(g)△H
(g)+HCl(g)△H在T℃时,向2.0L恒容密闭容器中充入0.40mol乙苯(g)和0.40mol Cl2(g)进行反应,反应过程中测定的部分数据见表:
| t/min | 0 | 1 | 2 | 5 | 10 |
| n(HCl)/mol | 0 | 0.12 | 0.20 | 0.32 | 0.32 |
| A. | 反应在0~2 min内的平均速率v(α-氯乙基苯)=0.10mol•L-1•min-1 | |
| B. | 10 min后,若保持其他条件不变,升高温度,达到新平衡时测得c(α-氯乙基苯)=0.18mol•L-1,则反应的△H>0 | |
| C. | 在T℃时,起始时若向容器中充入1.0 mol乙苯(g)、0.50 mol Cl2(g)和0.50 molα-氯乙基苯(g)、0.50 mol HCl(g),则反应将向正反应方向进行 | |
| D. | 在T℃时,起始时若向容器中充入2.0molα-氯乙基苯(g)和2.2mol HCl(g),达到平衡时,α-氯乙基苯(g)的转化率小于20% |
13.下列图示与对应的叙述相符的是( )
| A. |  图表示0.1molMgCl2•6H2O在空气中充分加热时固体质量随时间的变化 | |
| B. |  图表示用0.1000 mol•LˉlNaOH溶液滴定25.00 mLCH3COOH的滴定曲线,则c(CH3COOH)=0.0800 mol•Lˉ1 | |
| C. |  图表示恒温恒容条件下,2NO2(g)?N2O4(g)中,各物质的浓度与其消耗速率之间的关系,其中交点A对应的状态为化学平衡状态 | |
| D. |  图表示常温下,稀释HA、HB两种酸的稀溶液时,溶液pH随加水量的变化,则常温下,NaA溶液的pH小于同浓度的NaB溶液的pH |
11.1molX气体跟amolY气体在体积可变的密闭容器中发生如下反应:X(g)+aY(g)?bZ(g).反应达到平衡后,测得X的转化率为25%.而且,在同温同压下还测得反应前混合气体的密度是反应后混合气体密度的$\frac{5}{6}$,则a和b数值可能是( )
| A. | a=1,b=2 | B. | a=1,b=3 | C. | a=2,b=3 | D. | a=2,b=1 |
10.短周期主族元素 X、Y、Z、W的原子序数依次增大,X原子最外层电子比次外层多4个,Y、Z为相邻金属元素,Z的简单离子半径在同周期元素中最小,W与X同族.下列说法不正确的是( )
| A. | Z元素与氯元素通过离子键化合形成对应的氯化物 | |
| B. | 原子半径:Y>Z>W>X | |
| C. | Y 的最高价氧化物对应的水化物可溶于氯化铵溶液 | |
| D. | 气态氢化物的热稳定性:X>W |
9.下列根据事实推出的结论正确的是( )
| A. | Na2O2溶于水得到NaOH,所以Na2O2为碱性氧化物 | |
| B. | NaHSO4溶液、Na2CO3溶液分别呈酸性、碱性,则NaHSO4属于酸,Na2CO3属于碱 | |
| C. | HCl、NH3的水溶液都能导电,则HCl、NH3均属于电解质 | |
| D. | 用一束光照射稀豆浆时产生丁达尔效应,则稀豆浆属于胶体 |
8.已知室温下:
①[Fe(C2O4)3]3-(翠绿色)?Fe3+3C2O42- K1=2.7×10-19
②Fe(SCN)3?Fe3++3SCN- K2=5×10-4
③CaC2O4(s)?Ca2++C2O42- K3=4×10-8
下列关于1mol-L-l K3[Fe(C2O4)3]溶液说法错误的是( )
①[Fe(C2O4)3]3-(翠绿色)?Fe3+3C2O42- K1=2.7×10-19
②Fe(SCN)3?Fe3++3SCN- K2=5×10-4
③CaC2O4(s)?Ca2++C2O42- K3=4×10-8
下列关于1mol-L-l K3[Fe(C2O4)3]溶液说法错误的是( )
| A. | c(Fe3+)=1 xl0-5 mol•L-1 | |
| B. | 加水稀释,平衡①向右移动 | |
| C. | 加入等体积0.2 mol•L-1KSCN溶液,溶液变为血红色 | |
| D. | 加入等体积0.2 mol•L-1CaCl2溶液,可产生沉淀 |
7. 硫及其化合物对人类的生产和生活有着重要的作用.
硫及其化合物对人类的生产和生活有着重要的作用.
(1)重晶石(BaSO4)高温煅烧可发生一系列反应,其中部分反应如下:
BaSO4(s)+4C(s)═BaS(s)+4CO(g)△H=+571.2kJ•mol-1
BaS(s)═Ba(s)+S(s)△H=+460kJ•mol-1
已知:O2(g)+2C(s)═2CO(g)△H=-221kJ•mol-1,
请写出O2(g)氧化Ba(s)和S(s)生成1molBaSO4(s)的热化学方程式Ba(s)+S(s)+2O2(g)=BaSO4(s)△H=-1473.2kJ/mol.
(2)二氧化硫在一定条件下还可以发生如下反应:SO2 (g)+NO2(g)?SO3(g)+NO (g)△H=-42kJ•mol-1.在1L 恒容密闭容器中充入SO2(g) 和NO2 (g),所得实验数据如表:
①实验甲中,若2min 时测得放出的热量是4.2kJ,则0→2min时间内,用SO2(g)表示的平均反应速率υ(SO2)=0.05mol/(L•min)
②实验丙中,达到平衡时,NO2的转化率为40%;a=0.12
③由表中数据可推知,T1<T2(填“>”“<”或“=”),判断的理由是T1时,该反应的平衡常数K1=2.6,T2时,该反应的平衡常数K2=1,该反应正反应为放热反应,所以T1<T2 .
(3)甲烷在熔融固体氧化物中形成的燃料电池,其工作原理如图所示.
a是电池的正极(填“正”或“负”),b极的电极反应式为CH4+4O2--8e-=CO2+2H2O.
 硫及其化合物对人类的生产和生活有着重要的作用.
硫及其化合物对人类的生产和生活有着重要的作用.(1)重晶石(BaSO4)高温煅烧可发生一系列反应,其中部分反应如下:
BaSO4(s)+4C(s)═BaS(s)+4CO(g)△H=+571.2kJ•mol-1
BaS(s)═Ba(s)+S(s)△H=+460kJ•mol-1
已知:O2(g)+2C(s)═2CO(g)△H=-221kJ•mol-1,
请写出O2(g)氧化Ba(s)和S(s)生成1molBaSO4(s)的热化学方程式Ba(s)+S(s)+2O2(g)=BaSO4(s)△H=-1473.2kJ/mol.
(2)二氧化硫在一定条件下还可以发生如下反应:SO2 (g)+NO2(g)?SO3(g)+NO (g)△H=-42kJ•mol-1.在1L 恒容密闭容器中充入SO2(g) 和NO2 (g),所得实验数据如表:
| 实验 编号 | 温度 | 起始时物质的量/mol | 平衡时物质的量/mol | |
| n(SO2) | n(NO2) | n(NO) | ||
| 甲 | T1 | 0.80 | 0.20 | 0.18 |
| 乙 | T2 | 0.20 | 0.80 | 0.16 |
| 丙 | T2 | 0.20 | 0.30 | a |
②实验丙中,达到平衡时,NO2的转化率为40%;a=0.12
③由表中数据可推知,T1<T2(填“>”“<”或“=”),判断的理由是T1时,该反应的平衡常数K1=2.6,T2时,该反应的平衡常数K2=1,该反应正反应为放热反应,所以T1<T2 .
(3)甲烷在熔融固体氧化物中形成的燃料电池,其工作原理如图所示.
a是电池的正极(填“正”或“负”),b极的电极反应式为CH4+4O2--8e-=CO2+2H2O.
6.食醋是日常饮食中的一种调味剂,国家标准规定酿造食醋中醋酸含量不得低于3.5g/100mL.用中和滴定的方法可以测定食醋中醋酸的浓度,某白醋的醋酸浓度测定过程如图所示:
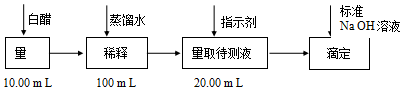
完成下列填空:
(1)稀释白醋时需要的仪器有烧杯、玻璃棒、胶头滴管、100mL容量瓶.
(2)应选用酚酞作为指示剂.达到滴定终点时,指示剂从无色变为浅红色.
(3)某同学一共进行了三次实验.以下是他设计的实验数据记录表,表格中A是滴定前读数,B是滴定后读数.
数据处理:消耗标准NaOH溶液的体积=21.32mL.
若测得稀释后白醋的浓度0.0594mol/L,则该食醋符合(选填“符合”、“不符合”)国家标准.
标准NaOH溶液通过以下步骤准备:①配制500mL浓度约为0.1mol/L的NaOH溶液;
②用KHC8H4O4标准溶液准确测定该NaOH溶液的浓度.
(4)称量所需的NaOH固体置于大烧杯中,加入500mL蒸馏水,搅拌溶解,该配制步骤可行可行
(填“可行”或“不可行”).
(5)NaOH标准溶液的浓度需通过测定而不能直接配制的原因是NaOH固体在称量时容易吸收空气中的水和CO2,使配制所得的溶液浓度低于预期浓度,导致实验误差.
0 163443 163451 163457 163461 163467 163469 163473 163479 163481 163487 163493 163497 163499 163503 163509 163511 163517 163521 163523 163527 163529 163533 163535 163537 163538 163539 163541 163542 163543 163545 163547 163551 163553 163557 163559 163563 163569 163571 163577 163581 163583 163587 163593 163599 163601 163607 163611 163613 163619 163623 163629 163637 203614

完成下列填空:
(1)稀释白醋时需要的仪器有烧杯、玻璃棒、胶头滴管、100mL容量瓶.
(2)应选用酚酞作为指示剂.达到滴定终点时,指示剂从无色变为浅红色.
(3)某同学一共进行了三次实验.以下是他设计的实验数据记录表,表格中A是滴定前读数,B是滴定后读数.
| 实验次数 | 稀释后白醋 体积(mL) | 标准NaOH溶液 | ||
| A | B | 消耗体积(mL) | ||
| 1 | 20.00 | 22.05 | ||
| 2 | 20.00 | 21.34 | ||
| 3 | 20.00 | 21.30 | ||
若测得稀释后白醋的浓度0.0594mol/L,则该食醋符合(选填“符合”、“不符合”)国家标准.
标准NaOH溶液通过以下步骤准备:①配制500mL浓度约为0.1mol/L的NaOH溶液;
②用KHC8H4O4标准溶液准确测定该NaOH溶液的浓度.
(4)称量所需的NaOH固体置于大烧杯中,加入500mL蒸馏水,搅拌溶解,该配制步骤可行可行
(填“可行”或“不可行”).
(5)NaOH标准溶液的浓度需通过测定而不能直接配制的原因是NaOH固体在称量时容易吸收空气中的水和CO2,使配制所得的溶液浓度低于预期浓度,导致实验误差.