20.青蒿素是一种有效的抗疟药.常温下,青蒿素为无色针状晶体,难溶于水,易溶于有机溶剂,熔点为156~157℃.提取青蒿素的方法之一是乙醚浸取法,提取流程如图1:
请回答下列问题:
(l)对青蒿进行破碎的目的是增大青蒿与乙醚的接触面积,提高青蒿素的浸取率.
(2)操作I用到的玻璃仪器是漏斗、玻璃棒、烧杯,操作Ⅱ的名称是蒸馏.
(3)用图2实验装置测定青蒿素的化学式,将28.2g青蒿素放在燃烧管C中充分燃烧:

①仪器各接口的连接顺序从左到右依次为afgdebchi(每个装置限用一次).A装置中发生的化学反应方程式为2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑.
②装置C中CuO的作用是使青蒿素充分氧化生成CO2和H2O.
③装置D中的试剂为浓硫酸.
④已知青蒿素是烃的含氧衍生物,用合理连接后的装置进行实验.测量数据如表:
则青蒿素的最简式为C15H22O5.
(4)某学生对青蒿素的性质进行探究.将青蒿素加入含有NaOH、酚酞的水溶液中,青蒿素的溶解度较小,加热并搅拌,青蒿素的溶解度增大,且溶液红色变浅,与青蒿素化学性质相似的物质是C(填字母代号).
A.乙醇 B.乙酸 C.乙酸乙酯 D.葡萄糖.
请回答下列问题:
(l)对青蒿进行破碎的目的是增大青蒿与乙醚的接触面积,提高青蒿素的浸取率.
(2)操作I用到的玻璃仪器是漏斗、玻璃棒、烧杯,操作Ⅱ的名称是蒸馏.
(3)用图2实验装置测定青蒿素的化学式,将28.2g青蒿素放在燃烧管C中充分燃烧:

①仪器各接口的连接顺序从左到右依次为afgdebchi(每个装置限用一次).A装置中发生的化学反应方程式为2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑.
②装置C中CuO的作用是使青蒿素充分氧化生成CO2和H2O.
③装置D中的试剂为浓硫酸.
④已知青蒿素是烃的含氧衍生物,用合理连接后的装置进行实验.测量数据如表:
| 装置质量 | 实验前/g | 实验后/g |
| B | 22.6 | 42.4 |
| E(不含干燥管) | 80.2 | 146.2 |
(4)某学生对青蒿素的性质进行探究.将青蒿素加入含有NaOH、酚酞的水溶液中,青蒿素的溶解度较小,加热并搅拌,青蒿素的溶解度增大,且溶液红色变浅,与青蒿素化学性质相似的物质是C(填字母代号).
A.乙醇 B.乙酸 C.乙酸乙酯 D.葡萄糖.
19.NA表示阿伏加德罗常数的数值.下列说法正确的是( )
| A. | 用惰性电极电解饱和食盐水,若电路中通过NA个电子,则阴极一定产生11.2LCl2 (标况) | |
| B. | lmolCH3COOC2H5在稀硫酸溶液中受热水解可得到乙醇分子数为NA | |
| C. | 含NA个Na+的Na2O2溶解于水配成2L溶液,所得溶液中Na+的物质的量浓度为0.5mol/L | |
| D. | 足量的MnO2固体与1L12mol/L的浓盐酸加热时反应,生成Cl2的分子数为3NA |
17.某小组为研究电化学原理,设计如图装置.下列叙述不正确的是( )


| A. | a和b不连接时,铁片上会有金属铜析出 | |
| B. | a和b用导线连接时,铜片上发生的反应为:Cu2++2e-═Cu | |
| C. | 无论a和b是否连接,铁片均会溶解,溶液均从蓝色逐渐变成浅绿色 | |
| D. | a和b之间用电流计连接时,指针不会发生偏转 |
16.某原电池反应的离子方程式为:Zn+2H+═Zn2++H2↑,则下列说法正确的是( )
| A. | HNO3为电解质溶液 | B. | 锌为原电池正极 | ||
| C. | 锌极质量不变 | D. | 铜为原电池正极 |
15.治理氮氧化物(NOx)的污染是化学研究的重要课题之一.NO能被灼烧的铁粉还原为N2,同时生成同时生成FeO,利用下列装置模拟该反应.

已知:①浓硝酸可氧化NO;②NaOH溶液能与NO2反应,不与NO反应.
(1)上述装置接口的连接顺序为a→f→e→j→i→h→g(或g→h)→b→c→d(按气流方向,用小写字母表示).
(2)装置D的作用是除去挥发出的HNO3、NO2等酸性气体.
(3)装置E中反应的化学方程式为2NO+2Fe$\frac{\underline{\;\;△\;\;}}{\;}$2FeO+N2.
(4)打开分液漏斗活塞,烧瓶中观察到的实验现象有反应开始时,铜片表面出现无色气泡,铜片逐渐变小,烧瓶上部空间由无色逐渐变为浅红棕色,随着反应的进行又逐渐变为无色;烧瓶中溶液由无色变为浅蓝色.
(5)实验室常用NaOH溶液吸收多余的氮氧化物(NOx):NO+NO2+2NaOH=2NaNO2+H2O.设计实验验证产物NaNO2既有氧化性又有还原性.
限选试剂:稀硫酸、KI-淀粉溶液、双氧水、酸性高锰酸钾溶液
(6)最终得到的亚硝酸钠(NaNO2)外观与食盐非常相似,毒性较强.
已知①Ksp(AgNO2)=2.0×10-8,Ksp(AgCl)=1.8×10-10;
②Ka(HNO2)=5.1×10-4.
若鉴别NaNO2和NaCl两种固体,实验方法是分别取两种固体样品少量于试管中加水溶解,再分别滴加酚酞试液,变红的为NaNO2(试剂自选).

已知:①浓硝酸可氧化NO;②NaOH溶液能与NO2反应,不与NO反应.
(1)上述装置接口的连接顺序为a→f→e→j→i→h→g(或g→h)→b→c→d(按气流方向,用小写字母表示).
(2)装置D的作用是除去挥发出的HNO3、NO2等酸性气体.
(3)装置E中反应的化学方程式为2NO+2Fe$\frac{\underline{\;\;△\;\;}}{\;}$2FeO+N2.
(4)打开分液漏斗活塞,烧瓶中观察到的实验现象有反应开始时,铜片表面出现无色气泡,铜片逐渐变小,烧瓶上部空间由无色逐渐变为浅红棕色,随着反应的进行又逐渐变为无色;烧瓶中溶液由无色变为浅蓝色.
(5)实验室常用NaOH溶液吸收多余的氮氧化物(NOx):NO+NO2+2NaOH=2NaNO2+H2O.设计实验验证产物NaNO2既有氧化性又有还原性.
限选试剂:稀硫酸、KI-淀粉溶液、双氧水、酸性高锰酸钾溶液
| 实验步骤 | 实验操作 | 现象 | 实验结论 |
| 1 | ① | ② | NaNO2具有氧化性 |
| 2 | ③ | ④ | NaNO2具有还原性 |
已知①Ksp(AgNO2)=2.0×10-8,Ksp(AgCl)=1.8×10-10;
②Ka(HNO2)=5.1×10-4.
若鉴别NaNO2和NaCl两种固体,实验方法是分别取两种固体样品少量于试管中加水溶解,再分别滴加酚酞试液,变红的为NaNO2(试剂自选).
14.LiFePO4新型锂离子动力电池具有稳定性高、安全、对环境友好等优点,可用于电动汽车.已知该电池放电时的电极反应式为:正极:FePO4+Li++e-═LiFePO4,负极:Li-e-═Li+.下列说法正确的是( )
| A. | 充电时电池反应式为FePO4+Li═LiFePO4 | |
| B. | 放电时在正极上是Li+得电子被还原 | |
| C. | 放电时电池内部Li+向正极移动 | |
| D. | 充电时动力电池上“+”的电极与外接电源的负极相连 |
13.对于Fe(s)+H2SO4(aq)═FeSO4(aq)+H2(g)△H<0的化学反应,下列叙述不正确的是( )
| A. | 若将该反应设计成原电池,反应时化学能转化为电能 | |
| B. | △H的值与反应方程式的化学计量数有关 | |
| C. | 若将该反应设计成原电池,铁棒为负极 | |
| D. | 若将其设计为原电池,当有28gFe溶解时,正极放出气体的体积11.2 L |
12.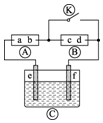 如图为直流电源,?为浸透饱和碘化钾溶液和淀粉溶液的滤纸,?为电镀槽.接通电路后发现?上的d点显蓝色.为实现铁上镀锌,接通
如图为直流电源,?为浸透饱和碘化钾溶液和淀粉溶液的滤纸,?为电镀槽.接通电路后发现?上的d点显蓝色.为实现铁上镀锌,接通 后,使c、d两点短路.下列叙述不正确的是( )
后,使c、d两点短路.下列叙述不正确的是( )
0 163031 163039 163045 163049 163055 163057 163061 163067 163069 163075 163081 163085 163087 163091 163097 163099 163105 163109 163111 163115 163117 163121 163123 163125 163126 163127 163129 163130 163131 163133 163135 163139 163141 163145 163147 163151 163157 163159 163165 163169 163171 163175 163181 163187 163189 163195 163199 163201 163207 163211 163217 163225 203614
 如图为直流电源,?为浸透饱和碘化钾溶液和淀粉溶液的滤纸,?为电镀槽.接通电路后发现?上的d点显蓝色.为实现铁上镀锌,接通
如图为直流电源,?为浸透饱和碘化钾溶液和淀粉溶液的滤纸,?为电镀槽.接通电路后发现?上的d点显蓝色.为实现铁上镀锌,接通 后,使c、d两点短路.下列叙述不正确的是( )
后,使c、d两点短路.下列叙述不正确的是( )| A. | f电极为锌板 | B. | c极发生的反应为2H++2e-═H2↑ | ||
| C. | a为直流电源的正极 | D. | e极发生氧化反应 |
 砷(As)是第四周期第VA族的元素,能形成多种化合物.回答下列问题:
砷(As)是第四周期第VA族的元素,能形成多种化合物.回答下列问题: .
. 磷及其化合物在生产生活中的用途非常广泛.回答下列问题:
磷及其化合物在生产生活中的用途非常广泛.回答下列问题: