题目内容
1. 砷(As)是第四周期第VA族的元素,能形成多种化合物.回答下列问题:
砷(As)是第四周期第VA族的元素,能形成多种化合物.回答下列问题:(1)同族元素的同类物质结构相似,AsH3的电子式为
 .
.(2)已知H3AsO3溶于水后的电离方程式为As3++3OH-?H3AsO3?3H++AsO33-.H3AsO3中砷的化合价为+3;若分别向上述平衡体系中加人稀硫酸、NaOH 溶液,则生成的正盐的化学式分别为As2(SO4)3、Na3AsO3.
(3)已知I2、AsO33-、I-、AsO43-之间存在如下转化:I2+AsO33-+2OH-?2I-+AsO43-+H2O.为验证该反应具有可逆性,某同学将等物质的量浓度的碘水与Na3AsO3溶液按体积比为V1:V2的比例混合(另加入适量的碱).当V1<V2(填“>”或“<”) 时,只用淀粉溶液就可以确定该反应具有可逆性.
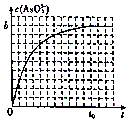
(4)常温下,将浓度均为2a mol•L-1的KI、Na3AsO4 溶液等体积混合后,溶液存在如下可逆反应:2I-(aq)+AsO43-(aq)+H2O (1)?I2(aq)+AsO33-(aq)+2OH-(aq),通过调整溶液的pH(加适量碱)来控制反应进行的方向.图是反应中c ( AsO33-)与时间t的关系图:
①反应达到平衡后,向溶液中加人少量固体NaOH,则重新达到平衡后,溶液中AsO43-的转化率减小(填“增大”、“减小”或“不变”),c(OH-)增大(填“增大”、“减小”或“不变”).
②若t0时刻,溶液的pH=8,则该反应的平衡常数K=$\frac{1{0}^{-12}{b}^{2}}{(a-2b)^{2}(a-b)}$.
(5)若使2I-(aq)+AsO43-(aq)+H2O (1)?I2(aq)+AsO33-(aq)+2OH-(aq)以原电池的方式进行,则正极的电极反应式为AsO43-+2e-+H2O=AsO33-+2OH-.
分析 (1)同族元素的同类物质结构相似,故AsH3属于共价化合物,不存在离子键,分子中存在3对共用电子对,氮原子最外层为8个电子;
(2)化合物中H为+1价,O为-2价,根据正负化合价代数和为0计算As的化合价;H3AsO3是两性偏酸性的化合物,与硫酸和氢氧化钠反应时都生成生成盐和水,据此进行分析;
(3)在化学方程式计算时以不足的作为计算对象,若碘不足,即V1<V2,若是普通的反应,则碘完全反应,添加淀粉溶液不变蓝色,若是可逆反应,则碘有剩余,添加淀粉溶液变蓝色,据此进行分析;
(4)①加入少量NaOH溶液,溶液中c(OH-)增加,平衡逆向移动,即c(AsO43-)减小,故AsO43-的转化率减小;加入少量NaOH溶液,溶液的碱性增强;
②pH=8,故c(H+)=1.0×10-8mol/L,则c(OH-)=$\frac{1.0×1{0}^{-14}}{1.0×1{0}^{-8}}$=1.0×10-6mol/L,
2I-(aq)+AsO43-(aq)+H2O (1)?I2(aq)+AsO33-(aq)+2OH-(aq)
开始(c) a a 0 0 0
变化 2b b b b 1.0×10-6
t0 a-2b a-b b b 1.0×10-6,K=$\frac{{c}^{2}(O{H}^{-})c(As{{O}_{3}}^{3-})c({I}_{2})}{{c}^{2}({I}^{-})c(As{{O}_{4}}^{3-})}$据此进行计算;
(5)正极得电子发生的还原反应据此书写电极反应方程式.
解答 解:(1)AsH3的电子式为: ,故答案为:
,故答案为: ;
;
(2)化合物H3AsO3中H为+1价,O为-2价,含As为x价,则(+1)×3+x+(-2×3)=0解得:x=+3;H3AsO3是两性偏酸性的化合物,与硫酸反应化学方程式为2H3AsO3+3H2SO4=As2(SO4)3+6H2O,所得盐的化学式为As2(SO4)3;与氢氧化钠反应化学方程式为H3AsO3+3NaOH=Na3AsO3+3H2O,所得盐的化学式为As2Na3AsO3,
故答案为:+3;As2(SO4)3;As2Na3AsO3;
(3)在化学方程式计算时以不足的作为计算对象,假设碘不足,即V1<V2,若是普通的反应,则碘完全反应,添加淀粉溶液不变蓝色,若是可逆反应,则碘有剩余,添加淀粉溶液变蓝色,要想确定该反应为可逆反应,即V1<V2;添加淀粉溶液变蓝色,
故答案为:<;淀粉溶液;
(4)①加入少量NaOH溶液,溶液中c(OH-)增加,平衡逆向移动,即c(AsO43-)减小,故AsO43-的转化率减小;加入少量NaOH溶液,溶液的碱性增强,溶液中c(OH-)浓度增大,
故答案为:减小;增大;
②pH=8,故c(H+)=1.0×10-8mol/L,则c(OH-)=$\frac{1.0×1{0}^{-14}}{1.0×1{0}^{-8}}$=1.0×10-6mol/L,
2I-(aq)+AsO43-(aq)+H2O (1)?I2(aq)+AsO33-(aq)+2OH-(aq)
开始(c) a a 0 0 0
变化 2b b b b 1.0×10-6
t0 a-2b a-b b b 1.0×10-6,K=$\frac{{c}^{2}(O{H}^{-})c(As{{O}_{3}}^{3-})c({I}_{2})}{{c}^{2}({I}^{-})c(As{{O}_{4}}^{3-})}$=$\frac{1{0}^{-12}{b}^{2}}{(a-2b)^{2}(a-b)}$,
故答案为:$\frac{1{0}^{-12}{b}^{2}}{(a-2b)^{2}(a-b)}$;
(5)正极发生的还原反应,故电极反应方程式为AsO43-+2e-+H2O=AsO33-+2OH-,
故答案为:AsO43-+2e-+H2O=AsO33-+2OH-.
点评 本题考查电子式的书写,元素价态的判断,平衡的移动,平衡常数的计算,电极方程式的书写等,本题综合性较大,难度中等.

| 选项 | 实验操作 | 现象 | 结论 |
| A | 向稀硝酸溶液中加入过量铁粉充分反应后,滴加KSCN溶液 | 溶液变为血红色 | 稀硝酸具有氧化性能将Fe氧化成Fe3+ |
| B | 向AgNO3溶液中滴加过量氨水 | 溶液澄清 | Ag+与NH3•H2O能大量共存 |
| C | 常温下分别测定浓度均为0.2mol/L的HClO溶液和0.1mol/LH2SO4溶液的pH | pH:HClO>H2SO4 | 非金属性:S>Cl |
| D | 向某溶液中滴加浓NaOH溶液,将湿润红色石蕊试纸置于试管口 | 试纸变蓝 | 该溶液中存在NH4+ |
| A. | A | B. | B | C. | C | D. | D |
| 元素 | I1 | I2 | I3 | I4 |
| X | 500 | 4600 | 6900 | 9500 |
| Y | 580 | 1800 | 2700 | 11600 |
| A. | 若元素Y处于第三周期,它可与冷水剧烈反应 | |
| B. | 元素Y是ⅢA族元素 | |
| C. | 元素X与氧形成化合物时,化学式可能是X2O或X2O2 | |
| D. | 元素X的常化合价是+1 |
| A. | HNO3为电解质溶液 | B. | 锌为原电池正极 | ||
| C. | 锌极质量不变 | D. | 铜为原电池正极 |
 短周期元素W、X、Y、Z、Q的原子序数依次增大,已知A、B、C、D是它们两种或三种元素间形成的化合物,且A、B、C均含有Z元素.A的焰色反应呈黄色,水溶液呈弱碱性;B是两性氢氧化物;D是由W与Q形成的化合物,0.1mol•L-1D溶液的pH为1.在一定条件下它们之间的相互转化关系如图所示.下列说法正确的是( )
短周期元素W、X、Y、Z、Q的原子序数依次增大,已知A、B、C、D是它们两种或三种元素间形成的化合物,且A、B、C均含有Z元素.A的焰色反应呈黄色,水溶液呈弱碱性;B是两性氢氧化物;D是由W与Q形成的化合物,0.1mol•L-1D溶液的pH为1.在一定条件下它们之间的相互转化关系如图所示.下列说法正确的是( )| A. | X、Y、Z元素的离子半径大小是X>Y>Z | |
| B. | X元素的氢化物沸点比同主族元素的氢化物低 | |
| C. | Q形成的单质在化学反应中只体现氧化性 | |
| D. | Q的氧化物对应水化物的酸性在同主族元素中是最强的 |
| A. | 分子式为C7H8O含有苯环且属于醇类的同分异构体有4种 | |
| B. | 乙炔能使溴的四氯化碳溶液褪色是发生了氧化反应 | |
| C. | 苯分子中所有原子都在同一平面上 | |
| D. | 乙酸乙酯少量乙酸杂质可加饱和NaOH溶液后经分液除去 |
| A. |  利用图所示操作制备氢氧化铁胶体 | |
| B. |  利用图所示装置制取NH3 | |
| C. |  制备Fe(OH)2:用图所示装置,向试管中加入NaOH溶液,振荡 | |
| D. |  用图装置测定中和热 |
| A. | 标准状况下,11.2LCCl4含有的分子数目为0.5NA | |
| B. | 将10mL 1 mol/L FeCl3溶浪滴入沸水中,所得氢氧化铁胶粒数为0.01NA | |
| C. | 1 mol/LNa2O2固体中含离子总数为3NA | |
| D. | 0.1moIH2O和D2O组成的混合物中含有中子数是NA |