题目内容
【题目】工业上利用氧化铝基废催化剂(主要成分为Al2O3,少量Pd)回收Al2(SO4)3及Pd的流程如下:
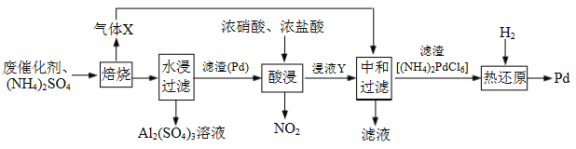
⑴焙烧时产生的气体X为_____________(填化学式)。
⑵浸液Y的主要成分为_____________(填化学式)。
⑶“热还原”过程中发生反应的化学方程式为____________。
⑷上述流程中焙烧温度不宜过高,否则会导致硫酸铵固体的分解。某兴趣小组为探究高温下硫酸铵的分解产物,通过下列装置进行实验,观察到B中溶液颜色变浅,C中无明显现象。
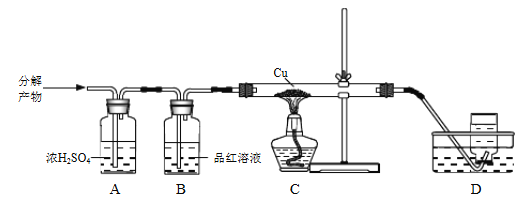
①装置B的作用是_____________。
②进一步测定可知,D中收集到的气体相对分子质量为28。写出(NH4)2SO4固体高温分解的化学方程式:_____________。
⑸Pd是优良的储氢金属,其储氢原理为2Pd(s)+x H2(g)=2PdHx(s),其中x的最大值为0.8。已知:Pd的密度为12g·cm-3,则1cm3Pd能够储存标准状况下H2的最大体积为
_____________L(计算结果保留整数)。
【答案】 NH3 H2PdCl6 (NH4)2PdCl6+2H2![]() Pd+2 NH3+6HCl 检验产物中的SO2 3(NH4)2SO4
Pd+2 NH3+6HCl 检验产物中的SO2 3(NH4)2SO4 ![]() 4NH3↑+N2↑+3SO2↑+6H2O↑ 1
4NH3↑+N2↑+3SO2↑+6H2O↑ 1
【解析】⑴硫酸铵焙烧时生成氨气,水、二氧化硫和三氧化硫,二氧化硫和三氧化硫与废催化剂中的氧化铝反应生成硫酸铝,产生的气体X为NH3,故答案为:NH3;
⑵根据流程图,滤渣中的Pd,与浓硝酸和浓盐酸的混合液反应生成H2PdCl6,在与氨气反应生成(NH4)2PdCl6,因此浸液Y的主要成分为H2PdCl6,故答案为:H2PdCl6;
⑶根据流程图,“热还原”过程中(NH4)2PdCl6发生反应后生成Pd,反应的化学方程式为(NH4)2PdCl6+2H2![]() Pd+2 NH3+6HCl,故答案为:(NH4)2PdCl6+2H2
Pd+2 NH3+6HCl,故答案为:(NH4)2PdCl6+2H2![]() Pd+2 NH3+6HCl;
Pd+2 NH3+6HCl;
⑷①根据题意,B中品红溶液颜色变浅,说明生成了二氧化硫,因此装置B的作用是检验产物中的SO2,故答案为:检验产物中的SO2;
②D中收集到的气体相对分子质量为28,为N2。C中无明显现象,说明没有氧气等氧化性物质生成,则(NH4)2SO4固体高温分解的产物主要有氮气、二氧化硫、氨气和水,反应的化学方程式为3(NH4)2SO4 ![]() 4NH3↑+N2↑+3SO2↑+6H2O↑,故答案为:3(NH4)2SO4
4NH3↑+N2↑+3SO2↑+6H2O↑,故答案为:3(NH4)2SO4 ![]() 4NH3↑+N2↑+3SO2↑+6H2O↑;
4NH3↑+N2↑+3SO2↑+6H2O↑;
⑸1cm3Pd的质量为12g,物质的量为![]() =
=![]() mol,储存H2的物质的量为
mol,储存H2的物质的量为![]() mol×0.8×
mol×0.8×![]() ,标准状况下的体积为
,标准状况下的体积为![]() mol×0.8×
mol×0.8×![]() ×22.4L/mol=1L,故答案为:1。
×22.4L/mol=1L,故答案为:1。




