题目内容
【题目】下图中,A、C是工业上用途很广的两种重要化工原料,B为日常生活中常见的金属,H、G是正四面体结构的非极性分子,H是一种重要的能源,J是一种耐高温材料,K是由两种常见元素组成的化合物(图中部分反应物或生成物没有列出)。
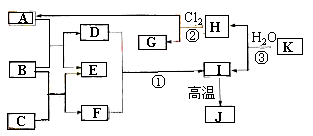
请按要求回答下列问题:
⑴写出B元素在周期表中的位置 K的化学式______________ 。
⑵反应①的离子方程式为_______________ 。
⑶将D的溶液蒸干且将所得的固体物质灼烧得到___________固体(写化学式),若要由D得溶液得到无水的D的固体,请简述其处理方法______________
⑷反应②进行的条件通常是 ,H和Cl2反应产物中有一种产物M的结构能证明G一定为正四面体结构请写出M的电子式 。
⑸J与焦炭在高温的情况下可以生成K和二氧化碳,请写出该反应的方程式____________ ;在此反应中氧化剂与还原剂的质量之比为____________
【答案】
(1)第三周期第ⅢA族;Al4C3
(2)Al3++3AlO2-+6H2O=4 Al(OH)3↓
(3)Al2O3 ;在干燥的氯化氢气流中加热蒸干
(4)光照;![]() ;
;
(5)2Al2O3+6C= Al4C3+3CO2;1:1
【解析】
试题分析:H、G是正四面体结构的非极性分子,H是一种重要的能源、燃料,则H为甲烷,结合反应②可知G为CCl4,A为HCl;J是耐高温材料且是两性氧化物,则J是Al2O3,B是金属,金属和酸反应生成盐和氢气,C是重要的化工原料,C和金属反应生成氢气和盐,则B是Al、C为NaOH,E是H2、D为AlCl3、F为NaAlO2,AlCl3和NaAlO2发生双水解反应生成Al(OH)3和NaCl,Al(OH)3分解生成Al2O3,所以I为Al(OH)3,K是由两种常见元素组成的化合物,且和水反应生成甲烷和Al(OH)3,根据元素守恒知,K为Al4C3。
(1)通过以上分析知,B为Al,元素Al在元素周期表中的位置是第三周期第IIIA族,K为Al4C3,故答案为:第三周期第IIIA族;Al4C3;
(2)氯化铝和偏铝酸钠反应生成氢氧化铝和氯化钠,离子方程式为Al3++3AlO2-+6H2O=4Al(OH)3↓,故答案为:Al3++3AlO2-+6H2O=4Al(OH)3↓;
⑶D为AlCl3,将溶液蒸干时氯化铝水解生成的氯化氢挥发,促进水解生成氢氧化铝沉淀,将氢氧化铝灼烧生成氧化铝,若要由氯化铝溶液得到无水的氯化铝固体,需要在氯化氢气流中加热蒸干,故答案为:Al2O3 ;在干燥的氯化氢气流中加热蒸干;
⑷ 反应②为甲烷与氯气的反应,需要在光照的条件下进行,二氯甲烷不存在同分异构体,可以证明四氯甲烷一定为正四面体结构,二氯甲烷的电子式为![]() ,故答案为:光照;
,故答案为:光照;![]() ;
;
⑸K为Al4C3,氯化铝与焦炭在高温的情况下可以生成Al4C3和二氧化碳,反应的方程式为2Al2O3+6C= Al4C3+3CO2,在此反应中氧化剂为碳,还原剂为碳,质量之比为1:1,故答案为:2Al2O3+6C= Al4C3+3CO2;1:1。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案