题目内容
能影响水的电离平衡,并使溶液中的c(H+)>c(OH-)的措施是( )
| A、向水中通入SO2 | B、将水加热煮沸 | C、向纯水中投入一小块金属钠 | D、向水中加入NaCl |
分析:c(H+)>c(OH-),溶液呈酸性,再根据影响水的电离的因素:温度、同离子效应、所加物质的酸碱性等具体分析水的电离平衡的移动.
解答:解:A、二氧化硫溶于水形成亚硫酸,溶液中的c(H+)>c(OH-),酸对水的电离起抑制作用,故A正确;
B、加热时促进水的电离,但是氢离子和氢氧根浓度依然相等,溶液仍然呈中性,故B错误;
C、加入金属钠,和水电离出的氢离子反应生成氢氧化钠和氢气,氢离子浓度降低,使水的电离向右移动,碱性增强,c(H+)<c(OH-),故C错误;
D、食盐在水中电离出钠离子与氯离子,两者都不能结合水电离的氢离子或氢氧根离子,不能使氢离子或氢氧根离子浓度变化,平衡不一定,不影响水的电离,溶液呈中性,故D错误;
故选A.
B、加热时促进水的电离,但是氢离子和氢氧根浓度依然相等,溶液仍然呈中性,故B错误;
C、加入金属钠,和水电离出的氢离子反应生成氢氧化钠和氢气,氢离子浓度降低,使水的电离向右移动,碱性增强,c(H+)<c(OH-),故C错误;
D、食盐在水中电离出钠离子与氯离子,两者都不能结合水电离的氢离子或氢氧根离子,不能使氢离子或氢氧根离子浓度变化,平衡不一定,不影响水的电离,溶液呈中性,故D错误;
故选A.
点评:本题考查了水的电离及其影响因素,题目难度不大,注意掌握影响水的电离的因素,注意题干条件要求c(H+)>c(OH-),试题培养了学生灵活应用所学知识的能力.

练习册系列答案
相关题目
能影响水的电离平衡,并使溶液中c(H+)>c(OH-)的措施是( )
| A、将水加热至100℃,测得pH=6 | B、向纯水中投入一小块金属钠 | C、向水中加入NH4Cl固体 | D、向水中加入Na2CO3固体 |
下列几种微粒中能影响水的电离平衡,且能使水的电离平衡向右移动的是( )
| A、HSO4- | B、Cl- | C、aX+ 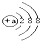 | D、bX2- 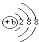 |
下列各组离子中,每个离子都能影响水的电离平衡的一组是( )
| A、Ag+、HCO3-、PO43-、SO42- | B、Br -、Al3+、H+、CO32- | C、Fe2+、SO32-、CH3COO -、S2- | D、ClO-、OH-、Cu2+、Ba2+ |