题目内容
物质W、X、Y、Z的转化关系如图所示,其中X、W是单质,Y、Z是化合物.(1)若X、W是常见的非金属单质,该反应在工业上可用来生产水煤气.
①该反应的化学方程式是______ CO+H2

【答案】分析:(1)该反应在工业上可用来生产水煤气,应为C和H2O的反应,则X为C,Y为H2O,W为H2,Z为CO;
(2)Y是红棕色固体,常用作红色油漆和涂料,应为Fe2O3,则X与Y的反应应为铝热反应,X为Al,W为Fe,Z为Al2O3.
解答:解:(1)该反应在工业上可用来生产水煤气,应为C和H2O的反应,则X为C,Y为H2O,W为H2,Z为CO,
①生产水煤气的反应方程式为C+H2O CO+H2,故答案为:C+H2O
CO+H2,故答案为:C+H2O CO+H2;
CO+H2;
②C、CO和H2常用于冶炼金属的还原剂,共3种,故答案为:c;
(2)Y是红棕色固体,常用作红色油漆和涂料,应为Fe2O3,则X与Y的反应应为铝热反应,X为Al,W为Fe,Z为Al2O3,
①该反应为铝热反应,反应的方程式为Fe2O3+2Al 2Fe+Al2O3,故答案为:Fe2O3+2Al
2Fe+Al2O3,故答案为:Fe2O3+2Al 2Fe+Al2O3;
2Fe+Al2O3;
②n(H2)= =0.015mol,方程式为2Al+2NaOH+2H2O=2NaAlO2+3H2↑,可知n(Al)=0.01mol,发生铝热反应可生成0.01molFe,故答案为:0.01.
=0.015mol,方程式为2Al+2NaOH+2H2O=2NaAlO2+3H2↑,可知n(Al)=0.01mol,发生铝热反应可生成0.01molFe,故答案为:0.01.
点评:本题考查无机物的推断,题目难度中等,本题注意把握物质的颜色、用于以及常见的工业反应,为解答该题的突破口,答题时要注意正确书写相关反应的化学方程式,可根据方程式计算.
(2)Y是红棕色固体,常用作红色油漆和涂料,应为Fe2O3,则X与Y的反应应为铝热反应,X为Al,W为Fe,Z为Al2O3.
解答:解:(1)该反应在工业上可用来生产水煤气,应为C和H2O的反应,则X为C,Y为H2O,W为H2,Z为CO,
①生产水煤气的反应方程式为C+H2O
 CO+H2,故答案为:C+H2O
CO+H2,故答案为:C+H2O CO+H2;
CO+H2;②C、CO和H2常用于冶炼金属的还原剂,共3种,故答案为:c;
(2)Y是红棕色固体,常用作红色油漆和涂料,应为Fe2O3,则X与Y的反应应为铝热反应,X为Al,W为Fe,Z为Al2O3,
①该反应为铝热反应,反应的方程式为Fe2O3+2Al
 2Fe+Al2O3,故答案为:Fe2O3+2Al
2Fe+Al2O3,故答案为:Fe2O3+2Al 2Fe+Al2O3;
2Fe+Al2O3;②n(H2)=
 =0.015mol,方程式为2Al+2NaOH+2H2O=2NaAlO2+3H2↑,可知n(Al)=0.01mol,发生铝热反应可生成0.01molFe,故答案为:0.01.
=0.015mol,方程式为2Al+2NaOH+2H2O=2NaAlO2+3H2↑,可知n(Al)=0.01mol,发生铝热反应可生成0.01molFe,故答案为:0.01.点评:本题考查无机物的推断,题目难度中等,本题注意把握物质的颜色、用于以及常见的工业反应,为解答该题的突破口,答题时要注意正确书写相关反应的化学方程式,可根据方程式计算.

练习册系列答案
相关题目
 物质W、X、Y、Z的转化关系如图所示,其中X、W是单质,Y、Z是化合物.
物质W、X、Y、Z的转化关系如图所示,其中X、W是单质,Y、Z是化合物.

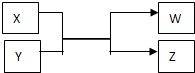 物质W、X、Y、Z的转化关系如图所示,其中X、W是单质,Y、Z是化合物.
物质W、X、Y、Z的转化关系如图所示,其中X、W是单质,Y、Z是化合物.