题目内容
(14分)研究CO2的利用对促进低碳社会的构建具有重要的意义。
(1)已知石墨的标准燃烧热为y kJ·mol-1,1.2g石墨在1.68L(标准状况)氧气中燃烧,至反应物耗尽,放出x kJ热量。则石墨与氧气反应生成CO的热化学方程式为 ,
(2)高温时,用CO还原MgSO4可制备高纯MgO。
①750℃时,测得气体中含等物质的量SO2和SO3,此时反应的化学方程式是 。
②由MgO可制成“镁—次氯酸盐”燃料电池,其装置示意图如图1,该电池反应的离子方程式为 。



图1 图2 图3
(3)二氧化碳合成甲醇是碳减排的新方向,将CO2转化为甲醇的热化学方程式为:
CO2(g) +3H2(g)  CH3OH(g) +H2O(g) △H
CH3OH(g) +H2O(g) △H
①该反应的平衡常数表达式为K= 。
②取五份等体积CO2和H2的混合气体(物质的量之比均为1∶3),分别加入温度不同、容积相同的恒容密闭容器中,发生上述反应,反应相同时间后,测得甲醇的体积分数φ(CH3OH)与反应温度T的关系曲线如图2所示,则上述CO2转化为甲醇反应的ΔH (填“>” “<”或“=”)0。
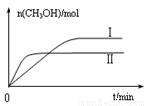
③在两种不同条件下发生反应,测得CH3OH的物质的量随时间变化如图3所示,曲线I、Ⅱ对应的平衡常数大小关系为KⅠ KⅡ(填“>” “<”或“=”)。
④一定温度下,在容积相同且固定的两个密闭容器中,按如下方式投入反应物,一段时间后达到平衡。
|
容 器 |
甲 |
乙 |
|
反应物 投入量 |
1molCO2 3molH2 |
a molCO2、b molH2、 c molCH3OH(g)、c molH2O(g) |
若甲中平衡后气体的压强为开始时的0.8倍,要使平衡后乙与甲中相同组分的体积分数相等,且起始时维持反应逆向进行,则c的取值范围为 。
(1)C(石墨) +1/2O2(g) = CO(g) △H 2=" -(20x-y)" kJ·mol-1(2分)
(2)①2MgSO4 + CO ="====" 2MgO + SO2 + CO2 + SO3(2分)。
②Mg + ClO- + H2O = Cl- + Mg(OH)2(2分)。
(3)①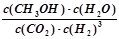 (2分)
(2分)
②< (2分)
③> (2分)
④0.4< c≤1 (2分)
【解析】
试题分析:(1)该反应式可由C(石墨)+O2(g)=CO2(g);△H1=-y kJ·mol-1,和C(石墨) +1/2O2(g) = CO(g);此反应碳过量,氧气不足,所以只反应了1.68/22.4=0.075mol,而1mol的反应放热应该为x*(1.5/0.075)=20x;再根据盖斯定理,△H 2="-(20x-y)" kJ·mol-1,最终答案为C(石墨) +1/2O2(g) = CO(g) △H
2=" -(20x-y)" kJ·mol-1;(2)①根据电子得失守恒,确定硫酸镁与二氧化硫和三氧化硫的计量数,再写方程。2MgSO4 + CO ="===="
2MgO + SO2 + CO2 + SO3。②先可以从图中看出得失电子的离子,再确定正负极的电极方程式,最后写总反应式:Mg + ClO- + H2O = Cl-
+ Mg(OH)2。(3)①根据公式可以写出: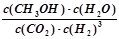 ,②由图二可知,ΔH<0,该反应正反应是放热反应,温度升高,反应速率和限度均会增大,但是温度升高到一定程度,反应向吸热反应即逆反应方向的趋势越来越大,使得甲醇的体积分数φ(CH3OH)反而减小。③根据图像可知,I的甲醇的物质的量大,转化率高,所以在计算时,平衡常数的公式中
,②由图二可知,ΔH<0,该反应正反应是放热反应,温度升高,反应速率和限度均会增大,但是温度升高到一定程度,反应向吸热反应即逆反应方向的趋势越来越大,使得甲醇的体积分数φ(CH3OH)反而减小。③根据图像可知,I的甲醇的物质的量大,转化率高,所以在计算时,平衡常数的公式中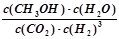 ,平衡常数大小关系为KⅠ>KⅡ。④根据化学平衡反应进行计算如下:
,平衡常数大小关系为KⅠ>KⅡ。④根据化学平衡反应进行计算如下:
CO2(g) +3H2(g)  CH3OH(g) +H2O(g)
CH3OH(g) +H2O(g)
始 1mol 3mol 0 mol 0 mol
变 x mol 3x mol x mol x mol
终 1-x 3-3x x x
由于压强是原来的0.8 ,所以[(1-x)+(3-3x)+x+x]/4=0.8算得x=0.4mol,根据等体积的等效平衡,各物质的量相同才可以,所以c的最大值是1mol,而保持平衡一开始向逆方向移动,所以c大于0.4mol。
考点:热化学方程式及方程式的书写,化学平衡
点评:本题综合热化学方程式的书写,盖斯定理和化学平衡状态的判断和计算,整体难度不大,计算也是使用较常规的三段式的方法,关键在于抓住等体积时等效平衡需要物质的量与原体系相同,两者才等效。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
 研究CO2的利用对促进低碳社会的构建具有重要的意义.
研究CO2的利用对促进低碳社会的构建具有重要的意义.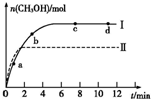 研究CO2的利用对促进低碳社会的构建具有重要的意义.
研究CO2的利用对促进低碳社会的构建具有重要的意义. CH3OH(g)+H2O(g)
△H
CH3OH(g)+H2O(g)
△H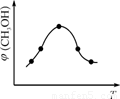
 =3,达平衡时CO2的转化率为60%,则NH3的平衡转化率为
=3,达平衡时CO2的转化率为60%,则NH3的平衡转化率为