题目内容
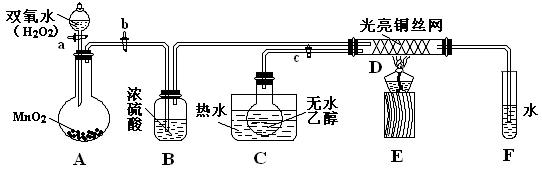
某实验小组用下列装置进行乙醇催化氧化的实验.已知:乙醛可被氧化为乙酸.
(1)实验过程中铜网出现红色和黑色交替的现象,请写出相应的化学方程式
(2)在不断鼓入空气的情况下,熄灭酒精灯,反应仍能继续进行,说明该乙醇催化反应是

试解释出现图中现象的原因:
(3)甲和乙两个水浴作用不相同.甲的作用是
(4)若试管a中收集到的液体用紫色石蕊试纸检验,试纸显红色,说明液体中还含有
A.氯化钠溶液B.苯 C.碳酸氢钠溶液D.四氯化碳
然后,再通过

(1)实验过程中铜网出现红色和黑色交替的现象,请写出相应的化学方程式
2Cu+O2
2CuO
| ||
2Cu+O2
2CuO
、
| ||
CH3CH2OH+CuO
CH3CHO+Cu+H2O
| ||
CH3CH2OH+CuO
CH3CHO+Cu+H2O
.
| ||
(2)在不断鼓入空气的情况下,熄灭酒精灯,反应仍能继续进行,说明该乙醇催化反应是
放热
放热
反应.进一步研究表明,鼓入空气的速率与反应体系的温度关系曲线如图所示.
试解释出现图中现象的原因:
流速过快的气体将体系中的热量带走
流速过快的气体将体系中的热量带走
.(3)甲和乙两个水浴作用不相同.甲的作用是
加热乙醇,便于乙醇的挥发
加热乙醇,便于乙醇的挥发
;乙的作用是冷却,便于乙醛的收集
冷却,便于乙醛的收集
.(4)若试管a中收集到的液体用紫色石蕊试纸检验,试纸显红色,说明液体中还含有
乙酸
乙酸
.要除去该物质,可在混合液中加入C
C
填写字母).A.氯化钠溶液B.苯 C.碳酸氢钠溶液D.四氯化碳
然后,再通过
蒸馏
蒸馏
(填实验操作名称)即可除去.分析:(1)乙醇的催化氧化反应实质是:金属铜被氧气氧化为氧化铜,氧化铜将乙醇氧化为乙醛,金属铜起催化剂作用;
(2)反应放的热可以部分代替酒精灯加热,根据图示曲线的变化来分析;
(3)热水浴和冷水浴的作用是不同的;
(4)能使紫色石蕊试纸变红的是酸,碳酸氢钠可以和乙酸反应.
(2)反应放的热可以部分代替酒精灯加热,根据图示曲线的变化来分析;
(3)热水浴和冷水浴的作用是不同的;
(4)能使紫色石蕊试纸变红的是酸,碳酸氢钠可以和乙酸反应.
解答:解:(1)乙醇的催化氧化反应过程:金属铜被氧气氧化为氧化铜,2Cu+O2
2CuO,氧化铜将乙醇氧化为乙醛,CH3CH2OH+CuO
CH3CHO+Cu+H2O,故答案为:2Cu+O2
2CuO;CH3CH2OH+CuO
CH3CHO+Cu+H2O;
(2)熄灭酒精灯,反应仍能继续进行,说明该乙醇催化反应是放热的,根据图示的曲线:反应放出的热的多少和乙醇以及氧气的量有关,鼓气多反应放热多,所以开始阶段温度升高,但是过量的气体会将体系中的热量带走,所以后阶段温度降低,故答案为:流速过快的气体将体系中的热量带走;
(3)甲和乙两个水浴作用不相同,甲是热水浴,作用是乙醇平稳气化成乙醇蒸气,乙是冷水浴,目的是将乙醛冷却下来,故答案为:加热乙醇,便于乙醇的挥发;冷却,便于乙醛的收集;
(4)若试管a中收集到的液体用紫色石蕊试纸检验,试纸显红色,说明液体中还含有乙酸,四个选择答案中,只有碳酸氢钠可以和乙酸反应,生成乙酸钠、水和二氧化碳,实现两种互溶物质的分离用蒸馏法,
故答案为:乙酸;C;蒸馏.
| ||
| ||
| ||
| ||
(2)熄灭酒精灯,反应仍能继续进行,说明该乙醇催化反应是放热的,根据图示的曲线:反应放出的热的多少和乙醇以及氧气的量有关,鼓气多反应放热多,所以开始阶段温度升高,但是过量的气体会将体系中的热量带走,所以后阶段温度降低,故答案为:流速过快的气体将体系中的热量带走;
(3)甲和乙两个水浴作用不相同,甲是热水浴,作用是乙醇平稳气化成乙醇蒸气,乙是冷水浴,目的是将乙醛冷却下来,故答案为:加热乙醇,便于乙醇的挥发;冷却,便于乙醛的收集;
(4)若试管a中收集到的液体用紫色石蕊试纸检验,试纸显红色,说明液体中还含有乙酸,四个选择答案中,只有碳酸氢钠可以和乙酸反应,生成乙酸钠、水和二氧化碳,实现两种互溶物质的分离用蒸馏法,
故答案为:乙酸;C;蒸馏.
点评:本题是一道考查乙醇化学性质的综合题,可以根据所学知识进行回答,难度较大.

练习册系列答案
相关题目