题目内容
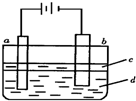 由于Fe(OH)2极易被氧化,实验室很难用亚铁盐溶液与烧碱反应制得白色纯净的Fe(OH)2沉淀.若用下图实验装置可制得纯净的Fe(OH)2沉淀,两极材料分别为石墨和铁.下列有关叙述正确的是( )
由于Fe(OH)2极易被氧化,实验室很难用亚铁盐溶液与烧碱反应制得白色纯净的Fe(OH)2沉淀.若用下图实验装置可制得纯净的Fe(OH)2沉淀,两极材料分别为石墨和铁.下列有关叙述正确的是( )分析:Fe(OH)2是借助反应Fe2++2OH-=Fe(OH)2↓生成的,制纯净的Fe(OH)2沉淀,Fe为阳极,失去电子,a与电源正极相连,则a为阳极,发生的电极反应为Fe-2e-=Fe2+,苯的密度水的小,不溶于水,可隔绝空气,防止氢氧化亚铁被氧化,并在实验加入苯之前,对d溶液进行加热处理的目的是排出溶液中的氧气,以此解答该题.
解答:解:A.a连接电源正极,为电解池的阳极,发生Fe-2e-=Fe2+,故A错误;
B.苯的密度水的小,不溶于水,可隔绝空气,防止氢氧化亚铁被氧化,而乙醇与水混溶,不能起到隔绝空气的作用,故B错误;
C.并在实验加入苯之前,对d溶液进行加热处理的目的是排出溶液中的氧气,防止生成的氢氧化亚铁被氧化,故C正确;
D.电解液d若是NaOH溶液,在电解池阳极生成亚铁离子,则白色沉淀在阳极附近生成;电解液d若是NaCl溶液,阳极生成亚铁离子,阴极生成氢氧根离子,阳离子向阴极移动,阴离子向阳极移动,则白色沉淀在两电极之间的溶液中生成,故D正确.
故选CD.
B.苯的密度水的小,不溶于水,可隔绝空气,防止氢氧化亚铁被氧化,而乙醇与水混溶,不能起到隔绝空气的作用,故B错误;
C.并在实验加入苯之前,对d溶液进行加热处理的目的是排出溶液中的氧气,防止生成的氢氧化亚铁被氧化,故C正确;
D.电解液d若是NaOH溶液,在电解池阳极生成亚铁离子,则白色沉淀在阳极附近生成;电解液d若是NaCl溶液,阳极生成亚铁离子,阴极生成氢氧根离子,阳离子向阴极移动,阴离子向阳极移动,则白色沉淀在两电极之间的溶液中生成,故D正确.
故选CD.
点评:本题考查电化学知识,侧重于氢氧化亚铁的制备方案的评价,题目难度不大,注意把握氢氧化亚铁的性质以及电解原理,要能正确书写反应的电极方程式.

练习册系列答案
相关题目
由于Fe(OH)2极易被氧化,所以实验室很难用亚铁盐溶液跟烧碱反应制得白色纯净的Fe(OH)2沉淀,应用如图所示装置可以制得白色纯净的Fe(OH)2沉淀。两极材料分别为铁和石墨。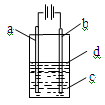
(1)a电极材料应为 ,电极反应式为 。
(2)电解液c最好是 (填编号)。
| A.纯水 | B.AgNO3溶液 | C.NaOH溶液 | D.CuCl2溶液 |
对c应作何简单处理? 。
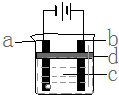 由于Fe (OH)2极易被氧化,所以实验室很难用亚铁盐溶液与烧碱反应制得白色纯净的Fe (OH)2沉淀,应用如图电解实验可以制得白色的纯净的Fe (OH)2沉淀.两电极材料分别为石墨和铁.
由于Fe (OH)2极易被氧化,所以实验室很难用亚铁盐溶液与烧碱反应制得白色纯净的Fe (OH)2沉淀,应用如图电解实验可以制得白色的纯净的Fe (OH)2沉淀.两电极材料分别为石墨和铁.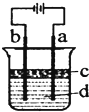 Ⅰ.用标准NaOH溶液滴定未知浓度的盐酸,用酚酞作指示剂,下列操作中会导致实验结果偏低的是
Ⅰ.用标准NaOH溶液滴定未知浓度的盐酸,用酚酞作指示剂,下列操作中会导致实验结果偏低的是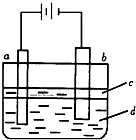 由于Fe(OH)2极易被氧化,所以实验室难用亚铁盐溶液与烧碱反应制得白色纯净的Fe(OH)2沉淀.
由于Fe(OH)2极易被氧化,所以实验室难用亚铁盐溶液与烧碱反应制得白色纯净的Fe(OH)2沉淀.