题目内容
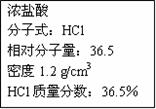
(11分)实验室常用的浓盐酸物质的量浓度约为12.0mol·L-1。
(1)实验室欲用上述浓盐酸配制480mL 0.20 mol·L—1的稀盐酸溶液,则需要取上述浓盐酸
mL?
(2)配制过程中,不需要的仪器(填写代号) ▲ 。
A.药匙 B.胶头滴管 C.玻璃棒 D.烧杯
完成实验还缺少的仪器是 ▲ 。
(3)取用任意体积的所配0.20 mol·L-1 HCl溶液时,下列物理量中不随所取体积的多少而变化的是 ▲ (填字母)
A.溶液中HCl的物质的量 B.溶液的浓度
C.溶液中Cl—的数目 D.溶液的密度
(4)用15.8g KMnO4氧化足量的上述浓盐酸。反应方程式如下:
2KMnO4 + 16HCl =" 2KCl" + 2Mn Cl 2 + 5Cl 2↑ + 8H2O
Cl 2 + 5Cl 2↑ + 8H2O
则:①有多少摩尔HCl被氧化?
②产生的Cl 2在标准状况下的体积为多少?
(1)实验室欲用上述浓盐酸配制480mL 0.20 mol·L—1的稀盐酸溶液,则需要取上述浓盐酸
mL?
(2)配制过程中,不需要的仪器(填写代号) ▲ 。
A.药匙 B.胶头滴管 C.玻璃棒 D.烧杯
完成实验还缺少的仪器是 ▲ 。
(3)取用任意体积的所配0.20 mol·L-1 HCl溶液时,下列物理量中不随所取体积的多少而变化的是 ▲ (填字母)
A.溶液中HCl的物质的量 B.溶液的浓度
C.溶液中Cl—的数目 D.溶液的密度
(4)用15.8g KMnO4氧化足量的上述浓盐酸。反应方程式如下:
2KMnO4 + 16HCl =" 2KCl" + 2Mn
 Cl 2 + 5Cl 2↑ + 8H2O
Cl 2 + 5Cl 2↑ + 8H2O则:①有多少摩尔HCl被氧化?
②产生的Cl 2在标准状况下的体积为多少?

略

练习册系列答案
相关题目
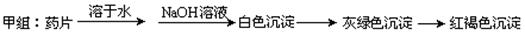 甲组同学按照设计的方案完成实验,但遗憾的是他们没有得到预期的实验结果,
甲组同学按照设计的方案完成实验,但遗憾的是他们没有得到预期的实验结果, 
 进行实验验证:________________________________
进行实验验证:________________________________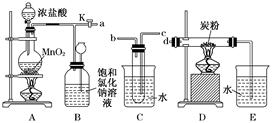
 斗中,然后再注入10 mL CCl4,盖好玻璃塞,振荡,静置于铁架台上,等分层后取上层液
斗中,然后再注入10 mL CCl4,盖好玻璃塞,振荡,静置于铁架台上,等分层后取上层液
 12分)过碳酸钠(Na2CO4)在洗涤、印染、造纸、医药卫生等领域有大量应用。
12分)过碳酸钠(Na2CO4)在洗涤、印染、造纸、医药卫生等领域有大量应用。 2H2O2 →2H2O+ O2↑.为测定已变质的过碳酸钠(含碳酸钠)的纯度,设计如图所示的实验:Q为—具有良好的弹性的气球(不与反应物和生成物反应),称取一定量的样品和少量二氧化锰放于其中,按图安装好实验装置,打开分液漏斗的活塞,将稀H2SO4滴入气球中。
2H2O2 →2H2O+ O2↑.为测定已变质的过碳酸钠(含碳酸钠)的纯度,设计如图所示的实验:Q为—具有良好的弹性的气球(不与反应物和生成物反应),称取一定量的样品和少量二氧化锰放于其中,按图安装好实验装置,打开分液漏斗的活塞,将稀H2SO4滴入气球中。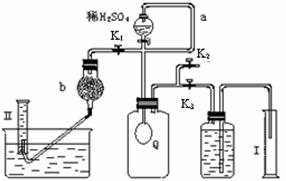
 ____________
____________ _____。
_____。 ,量筒液面高于水槽液面
,量筒液面高于水槽液面 2AlN+3CO中,氧化剂是 。
2AlN+3CO中,氧化剂是 。 CO2+2H2O+4Cu
CO2+2H2O+4Cu 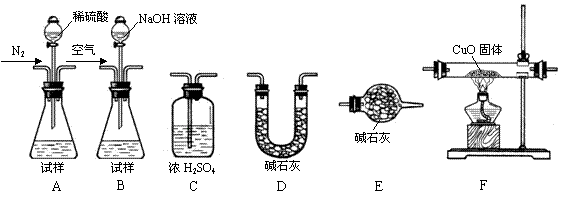 Ⅰ.测定样品中含有少量Al4C3的含量,各装置连接
Ⅰ.测定样品中含有少量Al4C3的含量,各装置连接 的顺序为A→C→F→C→D→E。主要实验步骤
的顺序为A→C→F→C→D→E。主要实验步骤 。
。

 子转移的方向和数目:
子转移的方向和数目: 为 mL。
为 mL。 必须选用的仪器有(填序号) ,除此还必需的仪器有
必须选用的仪器有(填序号) ,除此还必需的仪器有  )配制过程中,下列情况会使配制溶液的物质的量浓度偏高的是(填序号)
)配制过程中,下列情况会使配制溶液的物质的量浓度偏高的是(填序号)  中转移溶液时不慎有液滴掉在容量瓶外面 。
中转移溶液时不慎有液滴掉在容量瓶外面 。 用容量瓶前检查它是否漏水
用容量瓶前检查它是否漏水 应后的混合物过滤,再向得到的滤液中加入_____________溶液。
应后的混合物过滤,再向得到的滤液中加入_____________溶液。