题目内容
17.下列各组物质,前者属于电解质,后者属于非电解质的是( )| A. | NaCl晶体、CO2 | B. | 铜、二氧化硫 | ||
| C. | Na2CO3溶液、酒精 | D. | 熔融的KNO3、硫酸溶液 |
分析 电解质是在水溶液中或熔融状态下能导电的化合物,非电解质是在水溶液中和熔融状态下均不能导电的化合物.
解答 解:A.NaCl晶体的水溶液能导电,属于电解质;CO2和水反应生成碳酸,碳酸能电离出自由移动的阴阳离子,所以CO2的水溶液导电,但电离出离子的物质是碳酸不是CO2,所以CO2是非电解质,故A正确;
B.铜是单质,既不是电解质也不是非电解质;二氧化硫和水反应生成亚硫酸,亚硫酸能电离出自由移动的阴阳离子,所以二氧化硫的水溶液导电,但电离出离子的物质是亚硫酸不是二氧化硫,所以二氧化硫是非电解质,故B错误;
C.Na2CO3溶液是混合物,不是化合物,故C错误;
D.硫酸溶液是混合物,不是化合物,故D错误.
故选A.
点评 本题考查电解质和非电解质的概念,明确电解质和非电解质都是化合物,不是混合物是解题的关键,题目难度不大,学习中注意相关基础知识的积累.

练习册系列答案
 手拉手全优练考卷系列答案
手拉手全优练考卷系列答案
相关题目
7.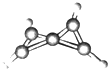 科学家最近在-100℃的低温下合成了一种烃X,经红外光谱和核磁共振表明其分子中的氢原子的化学环境没有区别,根据分析,绘制了如图所示的球棍模型.下列说法中错误的是( )
科学家最近在-100℃的低温下合成了一种烃X,经红外光谱和核磁共振表明其分子中的氢原子的化学环境没有区别,根据分析,绘制了如图所示的球棍模型.下列说法中错误的是( )
 科学家最近在-100℃的低温下合成了一种烃X,经红外光谱和核磁共振表明其分子中的氢原子的化学环境没有区别,根据分析,绘制了如图所示的球棍模型.下列说法中错误的是( )
科学家最近在-100℃的低温下合成了一种烃X,经红外光谱和核磁共振表明其分子中的氢原子的化学环境没有区别,根据分析,绘制了如图所示的球棍模型.下列说法中错误的是( )| A. | 烃X的分子式为C5H4 | |
| B. | 分子中只有一种类型的H原子 | |
| C. | 烃X在一定条件下能发生加成反应 | |
| D. | X分子中只有碳碳单键,没有碳碳双键 |
8.现有三组化合物:①汽油和氯化钠溶液 ②乙醇的水溶液 ③溴的水溶液,分离以上各混合液的正确方法依次是( )
| A. | 分液、蒸发、萃取 | B. | 分液、蒸馏、萃取 | C. | 萃取、蒸发、分液 | D. | 萃取、分液、蒸馏 |
5.25℃时,水的电离达到平衡:H2O?H++OH-△H>0,下列叙述正确的是( )
| A. | 向水中加入稀氨水,平衡逆向移动,c(OH-)降低 | |
| B. | 向水中加入少量固体硫酸氢钠,c(H+)增大,Kw不变 | |
| C. | 降温,使平衡左移,c(H+)减小,溶液呈碱性 | |
| D. | 将水加热,Kw增大,pH不变 |
12.下列各组中互为同位素的一组是( )
| A. | O2、O3 | B. | Na2O、Na2O2 | C. | 40K、40Ca | D. | H、D、T |
9.下列属于取代反应的是( )
| A. | H2C=CH2+H2$\stackrel{催化剂}{→}$H3C-CH3 | B. | 2CH3CH2OH+O2$\stackrel{Cu/△}{→}$2CH3CHO+2H2O | ||
| C. | 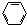 +3H2$\stackrel{Ni/△}{→}$ +3H2$\stackrel{Ni/△}{→}$ | D. | CH4+Cl2$\stackrel{光}{→}$CH3Cl+HCl |
6.下列电离方程式中,正确的是( )
| A. | Fe2(SO4)3═2Fe+3+3SO4-2 | B. | Ba(OH)2═Ba2++2(OH-) | ||
| C. | H2SO4═2H++SO42- | D. | Na2CO3═Na2++CO32- |
14.在标准状况时,下列物质的体积约为22.4L的是( )
| A. | 1 mol H2O | B. | 16 g O2 | C. | 1 mol Fe | D. | 2 g H2 |