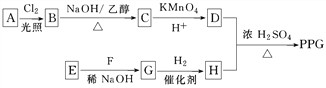
题目内容
【题目】下列图示与对应的叙述相符合的是

A. 图1表示平衡2NO2(g)![]() N2O4(g)在t1时迅速将体积缩小后c(N2O4)的变化
N2O4(g)在t1时迅速将体积缩小后c(N2O4)的变化
B. 图2表示除去CuSO4溶液中的Fe3+可采用加入CuO调节溶液pH到4~5
C. 图3表示MOH和ROH两种一元碱的溶液分别加水稀释时的pH变化,则碱性:MOH>ROH
D. 图4为KNO3和NaCl溶解度曲线,若除去NaCl中少量的KNO3,可在较高温度下制得浓溶液后,再冷却结晶、过滤、洗涤、干燥得纯净NaCl
【答案】B
【解析】2NO2(g)![]() N2O4(g)在t1时迅速将体积缩小,平衡正向移动,c(N2O4)变大,故A错误;根据图示pH到4~5时Fe3+完全沉淀,Cu2+不沉淀,所以除去CuSO4溶液中的Fe3+可采用加入CuO调节溶液pH到4~5,故B正确;图3表示MOH和ROH两种一元碱的溶液分别加水稀释时的pH变化,则碱性:MOH<ROH,故C错误;除去NaCl中少量的KNO3,可蒸发结晶、趁热过滤、洗涤、干燥,故D错误。
N2O4(g)在t1时迅速将体积缩小,平衡正向移动,c(N2O4)变大,故A错误;根据图示pH到4~5时Fe3+完全沉淀,Cu2+不沉淀,所以除去CuSO4溶液中的Fe3+可采用加入CuO调节溶液pH到4~5,故B正确;图3表示MOH和ROH两种一元碱的溶液分别加水稀释时的pH变化,则碱性:MOH<ROH,故C错误;除去NaCl中少量的KNO3,可蒸发结晶、趁热过滤、洗涤、干燥,故D错误。

【题目】欲使0.1mol/L的NaHCO3溶液中c(H+)、c(CO32-)、c(HCO3-)都减少,( )
A. 通入二氧化碳气体 B. 加入氢氧化钠固体
C. 通入氯化氢气体 D. 加入饱和石灰水溶液
【题目】实验室以蛇纹石酸浸出液(主要含Fe3+,还有一定量的Al3+、Mn2+、Ca2+、Mg2+等)为原料制备高纯氧化铁,流程如下:

已知流程中相关金属离子生成氢氧化物沉淀的pH如下表:
氢氧化物 | Fe3+ | Fe2+ | Al3+ |
开始沉淀的pH | 1.1 | 5.8 | 3.0 |
沉淀完全的pH | 3.2 | 8.8 | 5.0 |
(1)“还原”时,应选择_____________(填字母)。
A.Zn粉 B.NaClO溶液 C.Fe粉
(2)“滤渣”的主要成分除含有少量MnF2外,还含有_____________(填化学式)。
(3)“沉锰”时,已知:Ksp(MnS)=4.65×10–14。为确保沉锰完全[即溶液中c(Mn2+)<1.0×10–6 mol·L1],应保持溶液中c(S2-)>_____________mol·L-1。
(4)“除铝”时,控制溶液pH的范围为_____________。
(5)“氧化”时,常用酸性K2Cr2O7溶液检测是否残留未被氧化的金属离子,该反应的离子方程式为_____________。
(6)“沉铁”时,反应温度为85℃条件下,反应时间和反应终点pH对铁的沉淀率的影响分别如下图所示,则最佳的工艺条件是_____________。