题目内容
下列溶液中,物质的量浓度为1mol?L-1的是
- A.将40gNaOH溶于1L水所得的溶液
- B.将22.4LHCl气体溶于水并配成1L的溶液
- C.将0.5mol?L-1NaOH溶液100mL加热蒸发掉50g水的溶液
- D.含K+2mol的K2SO4溶液1L
D
分析:A、利用n= 计算物质的量,再利用c=
计算物质的量,再利用c= 计算浓度,注意体积为溶液的体积;
计算浓度,注意体积为溶液的体积;
B、利用n=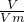 计算物质的量,Vm在标准状况下为22.4L/mol,再利用c=
计算物质的量,Vm在标准状况下为22.4L/mol,再利用c= 计算浓度;
计算浓度;
C、蒸发前后溶质的物质的量不变,体积之差不等于质量之差;
D、由化学式及钾离子的物质的量可知溶质的物质的量,再利用c= 计算浓度.
计算浓度.
解答:A、NaOH的物质的量为 =1mol,但1L水不是溶液的体积,则浓度不是1mol?L-1,故A错误;
=1mol,但1L水不是溶液的体积,则浓度不是1mol?L-1,故A错误;
B、因不一定是在标准状况下,则n不确定,无法计算,故B错误;
C、由蒸发前后溶质的物质的量不变,但溶液的密度不等于水的密度,体积之差不等于质量之差,故C错误;
D、含K+2mol的K2SO4,则溶质的物质的量为1mol,则c= =1mol/L,故D正确;
=1mol/L,故D正确;
故选D.
点评:本题考查物质的量浓度的有关计算,明确质量、体积、物质的量的关系即可计算,选项中的B、C都是学生容易出错的地方.
分析:A、利用n=
 计算物质的量,再利用c=
计算物质的量,再利用c= 计算浓度,注意体积为溶液的体积;
计算浓度,注意体积为溶液的体积;B、利用n=
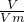 计算物质的量,Vm在标准状况下为22.4L/mol,再利用c=
计算物质的量,Vm在标准状况下为22.4L/mol,再利用c= 计算浓度;
计算浓度;C、蒸发前后溶质的物质的量不变,体积之差不等于质量之差;
D、由化学式及钾离子的物质的量可知溶质的物质的量,再利用c=
 计算浓度.
计算浓度.解答:A、NaOH的物质的量为
 =1mol,但1L水不是溶液的体积,则浓度不是1mol?L-1,故A错误;
=1mol,但1L水不是溶液的体积,则浓度不是1mol?L-1,故A错误;B、因不一定是在标准状况下,则n不确定,无法计算,故B错误;
C、由蒸发前后溶质的物质的量不变,但溶液的密度不等于水的密度,体积之差不等于质量之差,故C错误;
D、含K+2mol的K2SO4,则溶质的物质的量为1mol,则c=
 =1mol/L,故D正确;
=1mol/L,故D正确;故选D.
点评:本题考查物质的量浓度的有关计算,明确质量、体积、物质的量的关系即可计算,选项中的B、C都是学生容易出错的地方.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
下列溶液中有关物质的量浓度关系不正确的是( )
| A、0.1mol?L-1的NaHA溶液,其pH=4:c(HA-)>c(H+)>c(H2A)>c(A2-) | B、pH=2的HA溶液与pH=12的MOH溶液任意比混合:C(H+)+c(M+)=c(OH-)+c(A-) | C、pH相等的CH3COONa、NaOH和Na2CO3三种溶液:c(NaOH)<c(Na2CO3)<c(CH3COONa) | D、物质的量浓度相等CH3COOH和CH3COONa溶液等体积混合:2c(Na+)=c(CH3COO-)+c(CH3COOH) |
下列溶液中Cl-物质的量浓度最小的是( )
| A、100mL 2.5mol/L NaCl溶液 | B、200mL 2mol/L MgCl2溶液 | C、300mL 3mol/L KCl溶液 | D、250mL 1mol/L AlCl3溶液 |