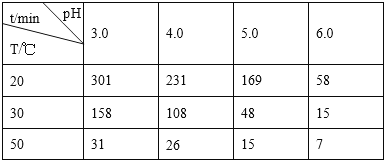
题目内容
【题目】H2与ICl的反应分①、②两步进行,其能量曲线如下图所示,下列有关说法错误的是( )
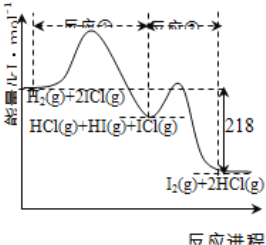
A.反应①、反应②均为放热反应
B.反应①、反应②均为氧化还原反应
C.反应①比反应②的速率慢,与相应正反应的活化能无关
D.反应①、反应②的焓变之和为△H=﹣218kJmol﹣1
【答案】C
【解析】
试题分析:A.根据图像可知,反应①和反应②中反应物总能量都大于生成物,则反应①、反应②均为放热反应,A正确;B.反应①中氢气参与反应,反应产物中都是化合物,则一定存在化合价变化,反应②中反应物都是化合物,生成物中有碘单质生成,则也一定存在化合价变化,所以反应①②均为氧化还原反应,B正确;C.反应①比反应②的速率慢,说明反应①中正反应的活化能较小,反应②中正反应的活化能较大,C错误;D.反应①、反应②总的能量变化为218kJ,根据盖斯定律可知,反应①、反应②的焓变之和为△H=-218kJmol-1,D正确;答案选C。

练习册系列答案
 直通贵州名校周测月考直通名校系列答案
直通贵州名校周测月考直通名校系列答案
相关题目