题目内容
25℃,pH=3的醋酸溶液(I)和pH=ll的氢氧化钠溶液(II),下列说法正确的是( )
| A.I和II中H2O的电离程度不相等 |
| B.将I稀释l0倍,溶液中c(CH3COOH)、c(OH﹣)均减小 |
| C.I和II溶液混合,若c(OH﹣)>c(H+),则氢氧化钠一定过量 |
| D.I和II等体积混合后,溶液中离子浓度大小为c(CH3COO﹣)+ c(CH3COOH>c(Na+) |
D
解析试题分析: pH=3的醋酸溶液(I)和pH=ll的氢氧化钠溶液(II)中的c(H+)=c(OH﹣)=0.001mol/L,因此对水电离的抑制作用相等,A错误;对I酸溶液进行稀释,溶液中OH-浓度越来越大,B错误;因为I是弱酸,II是强碱,若恰好完全中和得到的醋酸钠溶液也显碱性,所以C错误;若I和II等体积混合,则I中的醋酸过量,所以根据物料守恒c(CH3COO﹣)+ c(CH3COOH>c(Na+),故D正确;故选D。
考点:本题考查的是离子浓度的大小比较。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
室温下,下列溶液中粒子浓度大小关系正确的是
| A.Na2S溶液:c(Na+)>c(HS-)>c(OH-)>c(H2S) |
| B.Na2C2O4溶液中:c(OH-)=c(H+)+c(HC2O4-)+2c(H2C2O4) |
| C.Na2CO3溶液:c(Na+)+c(H+)=2c(CO32-)+c(OH-) |
| D.CH3COONa和CaCl2混合溶液:c(Na+)+c(Ca2+)=c(CH3COO-)+c(CH3COOH)+2c(Cl-) |
在不同温度下,水溶液中c( )与c(
)与c( )有如图所示关系,下列有关说法正确的是
)有如图所示关系,下列有关说法正确的是
| A.c点对应的溶液中大量存在的离子可能为:Na+、Al3+、Cl-、CO32- |
| B.将25℃时的NaCl溶液加热到t℃,则该溶液中的c(OH-)由a点变化到b点 |
| C.t℃>25℃ |
| D.ac线上的任意一点均有pH=7 |
下列叙述不正确的是
| A.在稀盐酸中 c(H+)=c(Cl—)+c(OH—) |
B.常温下,在0.1mol/L的HNO3溶液中由水电离出的c(H+)<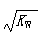 |
| C.将Na2CO3水溶液加热、蒸干,最后得到NaOH固体 |
| D.酸与碱完全中和,所得溶液的pH可能大于7 |
某化学研究性学习小组在学习了《化学反应原理》后作出了如下的归纳总结,其中正确的是
| A.pH=1和pH=2的盐酸,c(H+)之比为1:2 |
| B.物质A三态间的转化如下:A(g)→A(1)→A(s),则该转化过程中△S<O |
| C.pH=13的强碱溶液,加水稀释后,溶液中所有离子的浓度均变小 |
| D.pH=9的CH3COONa溶液和pH=9的NH3.H2O溶液,两溶液中水的电离程度相同 |
25℃时,向20.00mLNaOH溶液中逐滴加入0.20mo1·L-l的CH3COOH溶液得到如图曲线。下列说法正确的是
| A.水电离出的氢离子浓度:a>b |
| B.c点时恰好中和 |
| C.在d~e之间存在如下关系:C(Na十)>c(CH3COO-)>c(H十)>c(OH一) |
| D.e点时溶液中溶质是CH3COONa和CH3COOH |
下列叙述中正确的是 ( )
| A.明矾、硫酸铁都可以用于净水,但净水原理不同 |
| B.粗铝做阳极,硫酸铝溶液做电解液,电解精炼铝 |
| C.工业制硫酸中,将黄铁矿粉碎是为了提高黄铁矿的平衡转化率 |
| D.含有最高价元素的化合物,不一定有强氧化性 |
已知Ksp(AgCl)=1.78×10-10,Ksp(Ag2CrO4)=2.00×10-12。在只含有KCl、K2CrO4的混合溶液中滴加0.001 mol·L-1的AgNO3溶液,当AgCl与Ag2CrO4共存时,测得溶液中CrO42-的浓度是5.000×10-3 mol·L-1,此时溶液中Cl-的物质的量浓度是
| A.1.36×10-5 mol·L-1 |
| B.8.90×10-6 mol·L-1 |
| C.4.45×10-2 mol·L-1 |
| D.1×10-5 mol·L-1 |