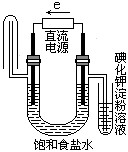
题目内容
将等物质的量的NaCl和CuSO4的溶解于水配成200mL混合溶液,通电电解到阴极刚有气体放出时停止电解,将阳极产生的气体在一定条件下恰好与5.6L标况下的H2反应。试求原溶液中两种溶质的物质的量浓度。
两种溶质的物质的量浓度为1.25mol/L。
解析:
本题可用H2 与Cl2和O2 反应转移的电子数等于电解时转移的电子数来进行计算,又知NaCl与CuSO4 等物质的量,则Cl-完全电解后还有一半物质的量的Cu2+没有电解,剩余的Cu2+电解时,阳极产生物是O2 其物质的量等于Cl2的一半。再根据H2 与Cl2和O2 的反应可算出Cl2 的物质的量。两种溶质的物质的量浓度也就可以算出。
解:设NaCl和CuSO4的物质的量为x mol。………………………0.5分
则有:2Cl--2e-=Cl2↑ 4OH--4e-=2H2O+O2↑ Cu2++2e-=Cu ………2分
x mol 0.5x mol x mol x mol
根据转移的电子数守恒可得n(O2)=(2x-x)mol÷4=0.25x mol………2分
又因为Cu2+电解是转移的电子数等于H2与Cl2和O2 转移的电子数可得
2x=×2
∴x=0.25mol……………………………………………………………2分
c(NaCl)= c(CuSO4)=0.25mol÷O.2L=1.25mol/L……………………1分

练习册系列答案
相关题目

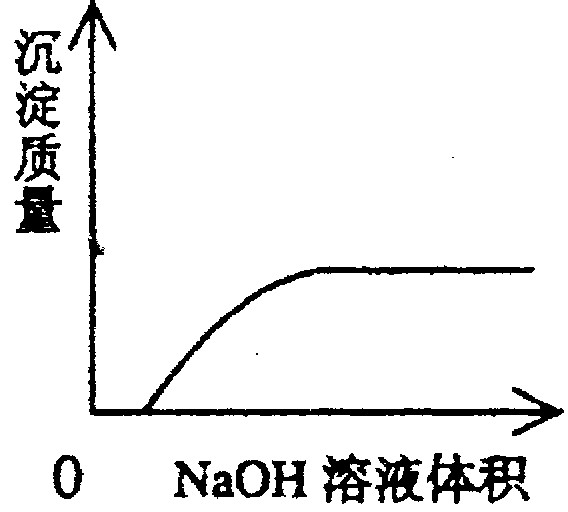

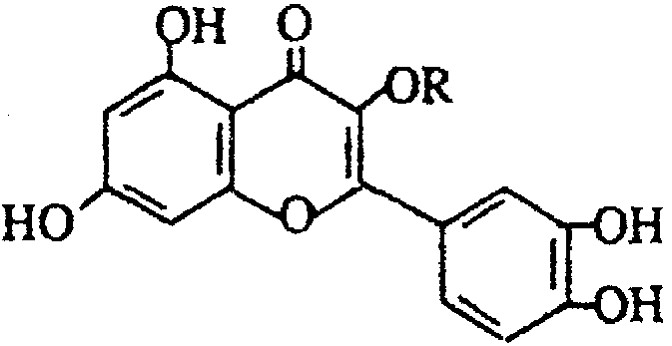
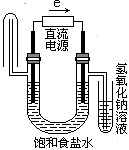 B、
B、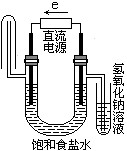
 D、
D、