题目内容
常温时,将某一元酸HA溶液与NaOH溶液等体积混合:
(1)若c (HA) = c (NaOH) =0.lmol/L,测得混合后溶液的pH>7。
①不能证明HA是弱电解质的方法是( )
A.测得0. 1mol/L HA的pH>l
B.测得NaA溶液的pH>7
C.pH=l的HA溶液与盐酸,稀释100倍后,盐酸的pH变化大
D.用足量锌分别与相同pH、相同体积的盐酸和HA溶液反应,产生的氢气一样多
②混合溶液中,关系式一定正确的是 ( )
A.c(A-)>c(Na+)>c(OH-)>c(H+)
B.c(A-)+c(OH-)=c(Na+)+c(H+)
C.c(HA)+c(A-)=0.1mol/L
D.c( HA) +c( H+)=c(OH-)
③若HA+B2-(少量)=A-+HB-、H2B(少量)+2C-=B2-+2HC、HA+C-=A-+HC,则相同pH的①NaA溶液;②Na2B溶液;③NaHB溶液;④NaC溶液,其物质的量浓度由大到小的顺序为 (填序号)。
(2)若c( HA)=c(NaOH)=0.1mol/L,测得混合后溶液的pH=7。
①现将一定浓度的HA溶液和0.1 mol/L NaOH溶液等体积混合后,所得溶液的pH跟该浓度的HA溶液稀释10倍后所得溶液的pH相等,则HA溶液的物质的量浓度为 mol/L。
②用标准的NaOH溶液滴定未知浓度的HA时,下列操作能引起所测HA浓度偏大的是 。
A.用蒸馏水洗涤锥形瓶后,用待测HA溶液进行润洗
B.滴定前发现滴定管的尖嘴部分有气泡,滴定后消失
C.装NaOH的碱式滴定管未用标准的NaOH溶液润洗
D.滴定前仰视,滴定后俯视读数
(3)若c(HA)= 0.04 mol/L,c(NaOH)=0.02 mol/L。
①若HA为CH3COOH,二者等体积混合后该溶液显酸性,则溶液中所有离子按浓度由大到小排列的顺序是 。
②若HA为强酸,99℃时(Kw=10-12),将两种溶液等体积混合后,溶液中由水电离出的H+浓度为 _ _ mol/L(假设混合后溶液体积为两溶液体积之和)。
(1)D ② BD ③ ③①②④ (2)0.125mol/L ② ABC
(3)c(A-)>c(Na+)>c(H+)>c(OH-) (或c(CH3COO-)>c(Na+)>c(H+)>c(OH-));10-10
【解析】
试题分析:(1)①弱电解质的证明,是基于与强电解质对比进行的。弱电解质与强电解质最大的区别就 是弱电解质存在电离平衡,而强电解质不存在电离平衡。因此只要证明有电离平衡存在, 就证明了弱电解质。A、如果HA是强酸,则0.1mol/L的HA溶液的pH=1,所以如果测得0.1mol/L HA的pH>l,这说明HA没有完全电离,存在电离平衡,即HA是弱电解质,A不符合题意;B、如果测得NaA溶液的pH>7,这说明-在溶液中水解,溶液显碱性,因此相应的是弱电解质,B不符合题意;C、盐酸是强酸,完全电离。因此如果pH=l的HA溶液与盐酸,稀释100倍后,盐酸的pH变化大,这就说明HA溶液中存在电离平衡,属于弱电解质,C不符合题意;D、如果用足量锌分别与相同pH、相同体积的盐酸和HA溶液反应,产生的氢气一样多,则说明两种酸的浓度是相同的。由于盐酸是强酸,因此HA也一定是强电解质,D符合题意,答案选D。
②c (HA)=c (NaOH)=0.lmol/L,则二者等体积混合恰好反应时生成NaA。测得混合后溶液的pH>7,这说明A-水解,溶液显碱性。则A、c(Na+)>c(A-)>c(OH-)>c(H+),A不正确;B、根据电荷守恒可知c(A-)+c(OH-)=c(Na+)+c(H+),B正确;C、根据物料守恒可知c(HA)+c(A-)=c(Na+)=0.1mol/L÷2=0.05mol/L,C不正确;D、根据质子守恒可知c( HA) +c( H+)=c(OH-),D正确,答案选BD。
③若HA+B2-(少量)=A-+HB-、H2B(少量)+2C-=B2-+2HC、HA+C-=A-+HC,则根据较强酸制备较弱酸可知,酸性强弱顺序是H2B>HA>HB->HC。由于酸性越强,相应的钠盐越容易水解,溶液的碱性越强,pH越大,因此在相同条件下水解程度的大小顺序是C->B2->A->HB-。所以相同pH的 ①NaA溶液 ②Na2B溶液 ③NaHB溶液 ④NaC溶液,其物质的量浓度由大到小的顺序为③①②④。
(2)若c( HA)=c(NaOH)=0.1mol/L,则二者等体积混合恰好反应时生成NaA。测得混合后溶液的pH=7,这说明生成物不水解,因此HA是强酸。
①现将一定浓度的HA溶液和0.1 mol/L NaOH溶液等体积混合后,所得溶液的pH跟该浓度的HA溶液稀释10倍后所得溶液的pH相等,则如果设HA溶液的物质的量浓度为cmol/L,则 =0.1cmol/L,解得c=0.125,即HA溶液的浓度是0.125mol/L。
=0.1cmol/L,解得c=0.125,即HA溶液的浓度是0.125mol/L。
②由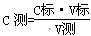 可知,由于C标、V测均为定植,所以C测的大小取决于V标的大小,即V标:偏大或偏小,则C测偏大或偏小,据此可以判断。A、用蒸馏水洗涤锥形瓶后,用待测HA溶液进行润洗,则消耗氢氧化钠溶液的体积增加,所以测量值偏高;B、滴定前发现滴定管的尖嘴部分有气泡,滴定后消失,则消耗氢氧化钠溶液的体积增加,所以测量值偏高;C、装NaOH的碱式滴定管未用标准的NaOH溶液润洗,则氢氧化钠溶液的浓度被稀释,消耗氢氧化钠溶液的体积增加,所以测量值偏高;D、滴定前仰视,读数偏大。滴定后俯视读数,读数偏小,因此消耗氢氧化钠溶液的以及减少,测量值偏低,答案选ABC。
可知,由于C标、V测均为定植,所以C测的大小取决于V标的大小,即V标:偏大或偏小,则C测偏大或偏小,据此可以判断。A、用蒸馏水洗涤锥形瓶后,用待测HA溶液进行润洗,则消耗氢氧化钠溶液的体积增加,所以测量值偏高;B、滴定前发现滴定管的尖嘴部分有气泡,滴定后消失,则消耗氢氧化钠溶液的体积增加,所以测量值偏高;C、装NaOH的碱式滴定管未用标准的NaOH溶液润洗,则氢氧化钠溶液的浓度被稀释,消耗氢氧化钠溶液的体积增加,所以测量值偏高;D、滴定前仰视,读数偏大。滴定后俯视读数,读数偏小,因此消耗氢氧化钠溶液的以及减少,测量值偏低,答案选ABC。
(3)①若HA为CH3COOH,二者等体积混合后醋酸过量,即溶液是由相同浓度的醋酸、醋酸钠构成的。该溶液显酸性,这说明醋酸的电离程度大于CH3COO-的水解程度,则溶液中所有离子按浓度由大到小排列的顺序是c(CH3COO-)>c(Na+)>c(H+)>c(OH-)。
②HA为强酸,二者等体积混合后HA过量,即溶液是由相同浓度的HA、NaA构成的,且浓度都是0.02mol/L÷2=0.01mol/L。因此溶液中OH-浓度=10-12÷0.01=10-10mol/L。HA是强酸,抑制水的电离,则溶液中由水电离出的H+浓度=溶液中OH-浓度=10-10mol/L。
考点:考查弱电解质的电离、盐类水解、弱电解质的判断、溶液中离子浓度大小比较、中和滴定实验误差分析以及水的离子积常数和pH的计算

 海淀黄冈名师导航系列答案
海淀黄冈名师导航系列答案 普通高中同步练习册系列答案
普通高中同步练习册系列答案