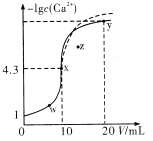
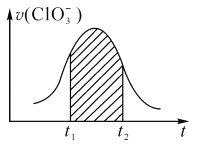
题目内容
【题目】化学反应速率是描述化学反应进行快慢程度的物理量。下面是某同学测定化学反应速率并探究其影响因素的实验。
Ⅰ.测定化学反应速率
该同学利用如图装置测定反应速率(药品:稀硫酸、Na2S2O3溶液等)。
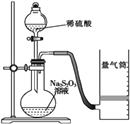
(1)除如图装置所示的实验用品外,还需要的一件实验仪器用品是________________;请写出在圆底烧瓶中所发生反应的离子方程式为___________________________________________。
(2)若在2 min时收集到224 mL(已折算成标准状况)气体,可计算出该2 min内H+的反应速率,而该测定值比实际值偏小,其原因是____________________________________。
(3)利用该化学反应,试简述测定反应速率的其他方法:___________________(写一种)。
Ⅱ.探究化学反应速率的影响因素
为探讨反应物浓度对化学反应速率的影响,设计的实验方案如下表。
(已知 I2+2 Na2S2O3= Na2S4O6+2 NaI,其中Na2S2O3溶液均足量)
实验序号 | 体积V/mL | 时间/s | |||
Na2S2O3溶液 | 淀粉溶液 | 碘水 | 水 | ||
① | 10.0 | 2.0 | 4.0 | 0.0 | T1 |
② | 8.0 | 2.0 | 4.0 | 2.0 | T2 |
③ | 6.0 | 2.0 | 4.0 | Vx | T3 |
(4)表中Vx=__________mL,该实验中加入淀粉的目的为_______________________;请判断T1、T2、T3的大小关系,并总结实验所得出的结论__________________________。
【答案】 秒表或计时器等 S2O32-+2H+=H2O+S↓+SO2↑ SO2会部分溶于水,收集得到的SO2比理论少 测定一段时间内生成硫沉淀的质量(或实时测定溶液中氢离子浓度,或其他合理答案) 4.0 作显色剂,淀粉与I2共存呈蓝色,判断反应所需时间 T1 <T2 <T3,反应物Na2S2O3浓度越大,反应速率越大
【解析】(1)测量反应速率时相应测量时间,因此除如图装置所示的实验用品外,还需要的一件实验用品是秒表或计时器等;圆底烧瓶中硫酸与硫代硫酸钠反应生成硫酸钠、二氧化硫、硫和水,所发生反应的离子方程式为:S2O32-+2H+=H2O+S↓+SO2↑;(2)由于SO2会部分溶于水,所以实际得到的气体体积偏小,则测定值比实际值偏小;(3)由于反应中还有单质S沉淀产生,所以利用该化学反应,还可以通过测定一段时间内生成硫沉淀的质量来测定反应速率;(4)为保持其他量相同,溶液的总体积是16ml,所以表中Vx=16ml—6.0ml—2.0mol—4.0ml=4.0mL;从反应原理看,可以采用淀粉作指示剂,根据碘水的淀粉溶液蓝色完全褪色所需时间来测定反应速率;反应物Na2S2O3浓度越大,反应速率越大,所以T1 <T2 <T3。