题目内容
4.下列物质转化需要加入氧化剂才能实现的是( )| A. | SO2→SO32- | B. | Cl2→HCl | C. | Na+→Na | D. | S→SO2 |
分析 转化后需要加入氧化剂才能实现,说明给予物质作还原剂,在反应中失电子化合价升高,据此分析解答.
解答 解:A.该反应中各元素化合价不变,不发生氧化还原反应就能实现,故A错误;
B.该反应中Cl元素化合价由0价变为-1价,则氯气是氧化剂,需要还原剂才能实现,如氢气,故B错误;
C.该反应中Na元素化合价由+1价变为0价,钠离子作氧化剂,需要还原剂才能实现,故C错误;
D.该反应中S元素化合价由0价变为+4价,则S是还原剂,需要氧化剂才能实现,如氧气,故D正确;
故选D.
点评 本题考查氧化还原反应,侧重考查基本概念,明确元素化合价变化与基本概念之间关系是解本题关键,熟悉常见元素化合价,题目难度不大.

练习册系列答案
 优生乐园系列答案
优生乐园系列答案 新编小学单元自测题系列答案
新编小学单元自测题系列答案
相关题目
14.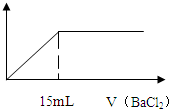 在10mL 0.05mo1/L的某金属硫酸盐溶液中,滴加0.1mo1/L BaCl2溶液,生成沉淀质量与加入BaCl2溶液体积关系如图所示,10mL该硫酸盐与足量的氢氧化钠完全反应生成10-3 mol沉淀,则该金属硫酸盐中金属元素的化合价为( )
在10mL 0.05mo1/L的某金属硫酸盐溶液中,滴加0.1mo1/L BaCl2溶液,生成沉淀质量与加入BaCl2溶液体积关系如图所示,10mL该硫酸盐与足量的氢氧化钠完全反应生成10-3 mol沉淀,则该金属硫酸盐中金属元素的化合价为( )
 在10mL 0.05mo1/L的某金属硫酸盐溶液中,滴加0.1mo1/L BaCl2溶液,生成沉淀质量与加入BaCl2溶液体积关系如图所示,10mL该硫酸盐与足量的氢氧化钠完全反应生成10-3 mol沉淀,则该金属硫酸盐中金属元素的化合价为( )
在10mL 0.05mo1/L的某金属硫酸盐溶液中,滴加0.1mo1/L BaCl2溶液,生成沉淀质量与加入BaCl2溶液体积关系如图所示,10mL该硫酸盐与足量的氢氧化钠完全反应生成10-3 mol沉淀,则该金属硫酸盐中金属元素的化合价为( )| A. | +1 | B. | +2 | C. | +3 | D. | +4 |
15.在一定温度下的恒容密闭容器中,当下列物理量不再发生变化时,表明反应A(s)+3B(g)═2C(g)+D(g)已达平衡状态的是( )
①混合气体的密度 ②混合气体的压强 ③B的物质的量浓度 ④气体的总物质的量 ⑤混合气体的平均相对分子质量.
①混合气体的密度 ②混合气体的压强 ③B的物质的量浓度 ④气体的总物质的量 ⑤混合气体的平均相对分子质量.
| A. | ①②③ | B. | ①④⑤ | C. | ①③⑤ | D. | ②③⑤ |
19.下列物质中,不能使干燥、有色布条褪色的是( )
| A. | “84”消毒液 | B. | 氯水 | C. | Cl2 | D. | 漂粉精溶液 |
9.NA表示阿伏加德罗常数,下列说法不正确的是( )
| A. | H2SO4的摩尔质量(kg/mol)与NA个硫酸分子的质量(g)在数值上相等 | |
| B. | NA个氧气分子和NA个氮气分子的质量比为8:7 | |
| C. | 1.5 L 0.3 mol•L-1Na2SO4溶液中含0.9NA个Na+ | |
| D. | 非标准状况下,22.4LO2中含有氧分子可能为NA个 |
16.常温下,下列说法正确的是( )
| A. | 在Na2CO3溶液中:c(OH-)-c(H+)=c(HCO3-)+c(H2CO3) | |
| B. | 0.2mol•L?1的CH3COONa溶液与0.1mol•L?1的HCl溶液等体积混合,溶液显酸性:c(Na+)>c(Cl-)>c(CH3COO-)>c(H+)>c(OH-) | |
| C. | pH相同的碳酸钠溶液与碳酸氢钠溶液:c(NaHCO3)>c(Na2CO3) | |
| D. | 0.1mol•L?1的HCN(弱酸)和0.1mol•L?1的NaCN等体积混合:c(HCN)+c(CN-)=c(Na+) |
13.化学在生产和日常生活中有着重要的作用.下列有关说法正确的是( )
| A. | “地沟油”经过加工处理后,可以用来制肥皂和生物柴油 | |
| B. | 氢氧化铁溶胶、水玻璃、淀粉溶液、PM2.5微粒均具有丁达尔效应 | |
| C. | 福尔马林可作食品的保鲜剂 | |
| D. | 浓硫酸可刻蚀石英制艺术品 |
14.下列说法中,正确的一项是( )
| A. | 氯化钠溶液是电解质 | |
| B. | 因为醋酸是弱电解质,所以醋酸在熔融状态下和在溶液中都不能导电 | |
| C. | 在氢气还原氧化铜的实验中,氢气是氧化剂 | |
| D. | 胶体的本质特征是粒子大小在1nm-100nm之间 |