题目内容
在25℃时,用石墨电极电解1.0L 2.5mol/LCuSO4溶液.5min后,在一个石墨电极上有3.2g Cu生成.试回答下列问题:
(1)试写出电解CuSO4溶液的化学方程式
(2)有
(3)如用等质量的两块铜片代替石墨作电极,电解相同时间后两铜片的质量相差
(1)试写出电解CuSO4溶液的化学方程式
2CuSO4+2H2O=2Cu+O2↑+2H2SO4
2CuSO4+2H2O=2Cu+O2↑+2H2SO4
.(2)有
0.1
0.1
mol电子发生转移,得到O2的体积(标准状况)是560
560
mL,溶液的PH是1
1
.(3)如用等质量的两块铜片代替石墨作电极,电解相同时间后两铜片的质量相差
6.4
6.4
g,电解液的pH不变
不变
(填“变小”、“变大”或“不变”)分析:(1)根据电解池的电解原理来书写电解反应方程式;
(2)根据阴极反应计算当有3.2g Cu生成时,反应所转移的电子数,两极上转移电子相等计算阳极上得到气体的体积;
(3)金金属铜作阳极时,本身失电子,金金属质量减轻,在阴极上,阳离子得电子析出金属.
(2)根据阴极反应计算当有3.2g Cu生成时,反应所转移的电子数,两极上转移电子相等计算阳极上得到气体的体积;
(3)金金属铜作阳极时,本身失电子,金金属质量减轻,在阴极上,阳离子得电子析出金属.
解答:解:(1)电解硫酸铜时,阳极上是氢氧根放电,阴极上是铜离子放电,
电解原理方程式为:2CuSO4+2H2O=2Cu+O2↑+2H2SO4,故答案为:2CuSO4+2H2O=2Cu+O2↑+2H2SO4;
(2)电解硫酸铜时,阴极上是铜离子放电,即Cu2++2e-→Cu,当该电极上有3.2g Cu生成时,转移电子为
×2=0.1mol,阳极上是氢氧根放电,即4OH-→O2↑+2H2O+4e-,当转移0.1mol电子时,则生成氧气的体积为:
×22.4L/mol=0.56L=560mL,减少的氢氧根的浓度为:
=0.1mol/L,所以电解后氢离子浓度为0.1mol/L,溶液的pH为1,故答案为:0.1;560;1;
(3)如用等质量的两块铜片代替石墨作电极,阳极反应式为:Cu→Cu2++2e-,当转移0.1mol电子时,该极质量减少3.2g,阴极反应式为:Cu2++2e-→Cu,当转移0.1mol电子时,该极质量增加3.2g,所以两铜片的质量相差6.4g,电解液的pH保持不变.故答案为:6.4;不变.
电解原理方程式为:2CuSO4+2H2O=2Cu+O2↑+2H2SO4,故答案为:2CuSO4+2H2O=2Cu+O2↑+2H2SO4;
(2)电解硫酸铜时,阴极上是铜离子放电,即Cu2++2e-→Cu,当该电极上有3.2g Cu生成时,转移电子为
| 3.2g |
| 64g/mol |
| 0.1mol |
| 4 |
| 0.1mol |
| 1.0L |
(3)如用等质量的两块铜片代替石墨作电极,阳极反应式为:Cu→Cu2++2e-,当转移0.1mol电子时,该极质量减少3.2g,阴极反应式为:Cu2++2e-→Cu,当转移0.1mol电子时,该极质量增加3.2g,所以两铜片的质量相差6.4g,电解液的pH保持不变.故答案为:6.4;不变.
点评:本题考查学生电解原理的有关知识,可以根据所学知识来回答,难度不大.

练习册系列答案
相关题目
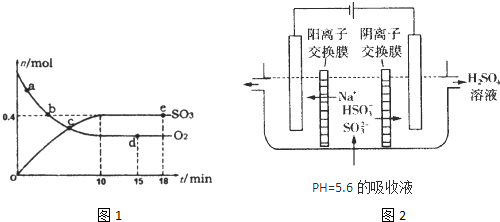
 Pa下,容积为1.0L的密闭容器中充入0.5molSO2,
(g)和0.3 molO2 (g),发生反应2SO2(g)+O2(g)
Pa下,容积为1.0L的密闭容器中充入0.5molSO2,
(g)和0.3 molO2 (g),发生反应2SO2(g)+O2(g) 2SO3(g)
△H=-198kJ/mol。反应中n(SO3)和n(O2)随时间变化的关系如右图所示
2SO3(g)
△H=-198kJ/mol。反应中n(SO3)和n(O2)随时间变化的关系如右图所示 。反应的平衡常数K=_______;0到10 min内用SO2表示的平均反应速率_________。根据图中信息,判断下列叙述中正确的是_____(填序号)。
。反应的平衡常数K=_______;0到10 min内用SO2表示的平均反应速率_________。根据图中信息,判断下列叙述中正确的是_____(填序号)。