题目内容
【题目】利用下面装置设计实验,制备SO2并进行探究。
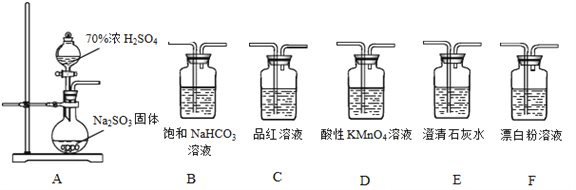
(1)装置A中反应的化学方程式:__________________。
(2)将A中产生的SO2持续通入装置G中直至过量。
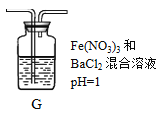
①G中有白色沉淀生成,其化学式为_________。
②写出反应初始时SO2被氧化的离子方程式:________________。
(3)选用A~F中的装置验证H2SO4的酸性强于H2CO3,能作为依据的实验现象是:________。
(4)要证明H2SO3的酸性强于HClO,所选装置(A~F中)的连接顺序为(填序号):A__________________。
【答案】Na2SO3+H2SO4(浓)=Na2SO4+SO2↑+H2OBaSO43SO2+2NO3-+2H2O=2NO↑+3SO42-+4H+C中品红溶液(或D中KMnO4溶液)不褪色、E中石灰水变浑浊B→D→F (或B→C→F或 B→D→C→F 或 B→C→D→F)
【解析】(1)装置A中反应为制备二氧化硫的反应,化学方程式为:Na2SO3+H2SO4(浓)=Na2SO4+SO2↑+H2O;故答案为:Na2SO3+H2SO4(浓)=Na2SO4+SO2↑+H2O;
(2)二氧化硫通入D中,被硝酸根氧化为硫酸根,3SO2+2NO3-+2H2O=2NO↑+3SO42-+4H+,与钡离子反应生成硫酸钡沉淀,Ba2++SO42-=3BaSO4↓;故答案为:①BaSO4;②3SO2+2NO3-+2H2O=2NO↑+3SO42-+4H+;
(3)二氧化硫应该先通入NaHCO3溶液,将生成的气体通入酸性高锰酸钾中吸收二氧化硫气体后,再将气体通入C品红(DKMnO4溶液),品红不褪色(D高锰酸钾),或者E澄清石灰水,澄清石灰水变浑浊,说明生成二氧化碳气体,证明H2SO3>H2CO3,又酸性:H2SO4>H2SO3,说明H2SO4的酸性强于H2CO3;故答案为:C中品红溶液(或D中KMnO4溶液)不褪色、E中石灰水变浑浊;
(4)要证明H2SO3的酸性强于HClO,因为二氧化硫与次氯酸根离子发生氧化还原反应,不能直接通入漂白粉溶液中,证明酸性H2SO3>H2CO3>HClO即可:应先用二氧化硫制备二氧化碳,制备的二氧化碳中有二氧化硫,故通入漂白粉之前除去二氧化硫气体,再用品红检验二氧化硫是否除净,再通入漂白粉中,故顺序为:A→B→D→C→F;故答案为:B→D→C→F。