题目内容
【题目】氮及其化合物在工农业生产生活中应用广泛,请解决下列问题。
(1)化合物甲(由氮和另一种常见的主族元素组成)是一种新型无机材料。将 8.2g 甲溶于足量的氢氧化钠溶液,可产生标准状况下为 4.48L 的气体,该气体可作制冷剂。向反应后的溶滚中逐滴加入稀盐酸,产生白色沉淀质量最大为 15.6g,继续滴加沉淀消失。则甲溶于氢氧化钠的化学方程式为_____________________。
(2)NH3催化还原氮氧化物是目前应用广泛的烟气氮氧化物脱除技术。例如:
4NH3(g)+6NO(g)![]() 5N2(g)+6H2O(g) △H1
5N2(g)+6H2O(g) △H1
己知:①H2O(l)=H2O(g) △H2
②4NH3(g)+5O2(g)=4NO(g)+6H2O(g) △H3
则 NH3(g)的标准燃烧热△H=____________________。
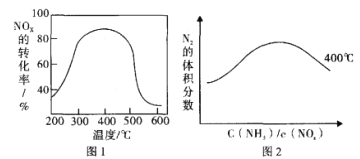
(3)以FeSO4作催化剂在不同温度下,经过相同的时间测试氨还原氮氧化物效果如图1,当反应在400~450℃,NOx 的转化率随温度升高而降低。当体系温度升至 500℃以上时. NOx 的转化率迅速下降,其可能原因是______________________。图2反映的是在400℃N2的体积分数与反应物中 c(NH3)/c(NOx)的关系,请在下面的图2上画出450℃的变化趋势曲线。
(4)N2O5 是绿色硝化试剂,溶于水可得硝酸。下图是以 N2O4为原料电解制备N2O5的装置示意图。写出阳极区生成 N2O5 的电极反应式是________________。

(5)常温下,向 0.1mol/L 氨水中加入少许 N2O5,使溶液中 c(NH3·H2O):c(NH4+)=5:9,此时溶液的 pH=___________。( 25℃时. NH3·H2O 的电离平衡常数 Kb=1.8×10-5)
【答案】
(1) AlN+NaOH+H2O=NaAlO2+NH3↑;
(2) ![]() ;
;
(3)催化剂活性降低( FeSO4 受热分解); ;
;
(4) N2O4-2e-+2HNO3=2N2O5+2H+(写成 N2O4-2e-+2NO3-=2N2O5 给分);
(5) 9。
【解析】
试题分析:(1)化合物甲(由氮和另一种常见的主族元素组成),溶于足量的氢氧化钠溶液,产生的气体可作制冷剂为氨气,产生标准状况下为4.48L的气体,n(NH3)=![]() =0.2mol,反应后的溶滚中逐滴加入稀盐酸,先沉淀后沉淀为溶解,为铝的化合物的特征,产生白色沉淀质量最大为15.6g,为氢氧化铝,n[Al(OH)3]=
=0.2mol,反应后的溶滚中逐滴加入稀盐酸,先沉淀后沉淀为溶解,为铝的化合物的特征,产生白色沉淀质量最大为15.6g,为氢氧化铝,n[Al(OH)3]=![]() =0.2mol,则m(N)+m(Al)=0.2mol×14g/mol+0.2mol×27g/mol=8.2g,则8.2g甲为AlN,甲溶于氢氧化钠的化学方程式为AlN+NaOH+H2O=NaAlO2+NH3↑,故答案为:AlN+NaOH+H2O=NaAlO2+NH3↑;
=0.2mol,则m(N)+m(Al)=0.2mol×14g/mol+0.2mol×27g/mol=8.2g,则8.2g甲为AlN,甲溶于氢氧化钠的化学方程式为AlN+NaOH+H2O=NaAlO2+NH3↑,故答案为:AlN+NaOH+H2O=NaAlO2+NH3↑;
(2)氨气燃烧生成氮气和水,①4NH3(g)+6NO(g)5N2(g)+6H2O(g)△H1②H2O(l)=H2O(g)△H2 ③4NH3(g)+5O2(g)=4NO(g)+6H2O(g)△H3根据盖斯定律,将已知热化学方程式![]() (③×3+①×2-②×30)得:4NH3(g)+3O2(g)=2N2(g)+6H2O(l)△H=
(③×3+①×2-②×30)得:4NH3(g)+3O2(g)=2N2(g)+6H2O(l)△H=![]() ,故答案为:
,故答案为:![]() ;
;
(3)当反应在400~450℃,NOx的转化率随温度升高而降低.当体系温度升至500℃以上时,催化剂硫酸亚铁受热分解,催化剂活性降低,所以450℃的变化趋势曲线图为: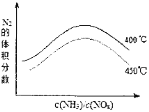 ,故答案为:催化剂活性降低(FeSO4受热分解);
,故答案为:催化剂活性降低(FeSO4受热分解);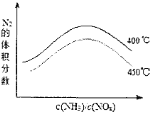 ;
;
(4)NO2可电解制备绿色硝化试剂N2O5.N元素化合价升高,NO2被氧化,电极方程式为N2O4-2e-+2HNO3=2N2O5+2H+,故答案为:N2O4-2e-+2HNO3=2N2O5+2H+;
(5)常温下,向0.1mol/L氨水中加入少许N2O5,五氧化二氮和水反应生成硝酸,硝酸和氨水反应,溶液中c(NH3H2O):c(NH4+)=5:9,溶液中溶质为硝酸铵和一水合氨,NH3H2ONH4++OH-,25℃时.NH3H2O的电离平衡常数Kb=1.8×10-5=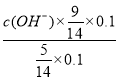 ,c(OH-)=10-5mol/L,c(H+)=10-9mol/L,PH=9,故答案为:9。
,c(OH-)=10-5mol/L,c(H+)=10-9mol/L,PH=9,故答案为:9。

 永乾教育寒假作业快乐假期延边人民出版社系列答案
永乾教育寒假作业快乐假期延边人民出版社系列答案