题目内容
20.化学式为C4H5Cl的有机物,其结构不可能是( )| A. | 含一个叁键的直链有机物 | B. | 含有两个双键的直链有机物 | ||
| C. | 含一个双键的环状有机物 | D. | 只含单键且两个环的环状有机物 |
分析 把Cl原子看成氢原子,可知C4H5Cl的不饱和度为2,一个双键的不饱和度为1,一个三键的不饱和度为2,一个环的不饱和度为1.
解答 解:A.C4H5Cl的不饱和度为2,含一个叁键的直链有机物的不饱和度为2,故A正确;
B.C4H5Cl的不饱和度为2,含有两个双键的直链有机物的不饱和度为2,故B正确;
C.C4H5Cl的不饱和度为2,含一个双键的环状有机物的不饱和度为2,故C正确;
D.C4H5Cl的不饱和度为2,只含单键且两个环的环状有机物至少6个碳原子,故D错误;
故选:D.
点评 本题主要考查了不饱和度的概念,难度不大,根据所学知识即可完成.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
11.下列突发事件处理方法正确的是( )
| A. | 电器着火,立即用水烧灭 | B. | 煤气泄漏,立即开灯查看 | ||
| C. | 房间着火,立即开窗通风 | D. | 油锅着火,立即盖上锅盖 |
8.常温下,在溶液中可发生以下反应:①2Fe2++Br2=2Fe3++2Br-,②2Br-+Cl2=Br2+2Cl-,③2Fe3++2I-=2Fe2++I2;由此判断下列说法错误的是( )
| A. | 铁元素在反应①中被氧化,在③中被还原 | |
| B. | 反应②中当有1 mol Cl2被还原时,有2 mol Br-被氧化 | |
| C. | 氧化性强弱顺序为:Cl2>I2>Br2>Fe3+ | |
| D. | 还原性强弱顺序为:I->Fe2+>Br->Cl- |
5.进行化学实验时应强化安全意识.下列做法正确的是( )
| A. | 用试管加热碳酸氢钠固体时使试管口竖直向上 | |
| B. | 浓硫酸溅到皮肤上时立即用稀氢氧化钠溶液冲洗 | |
| C. | 在石油分馏的实验中,需要在蒸馏烧瓶中加入碎瓷片 | |
| D. | 温度计摔坏导致水银散落到地面上,应立即用水冲洗水银 |
12.下列叙述正确的是( )
| A. | 电镀时,通常把待镀的金属制品作阳极 | |
| B. | 氯碱工业是电解熔融的NaCl,在阳极能得到Cl2 | |
| C. | 氢氧燃料电池(酸性电解质)中O2通入正极,电极反应为O2+4H++4e-═2H2O | |
| D. | 工业冶炼金属铝的方法是电解熔融的氯化铝 |
9.关于热化学方程式:2H2(g)+O2(g)=2H2O(l)△H=-571.6kJ•mol,下列有关叙述错误的是( )
| A. | 2 mol H2完全燃烧生成液态水时放出571.6kJ的热 | |
| B. | 1 mol H2完全燃烧生成液态水时放出285.8kJ的热 | |
| C. | 2 个H2分子完全燃烧生成液态水时放出571.6kJ的热 | |
| D. | 上述热化学方程式可以表示为:H2(g)+1/2O2(g)=H2O(l)△H=-285.8kJ•mol-1 |
10.现有常温下pH=2的盐酸甲和pH=2的醋酸溶液乙,请根据下列操作回答问题:
(1)常温下0.1mol/L的CH3COOH溶液加水稀释过程,下列表达式的数据一定变小的是A.
A.c(H+) B.$\frac{c({H}^{+})}{c(C{H}_{3}COOH)}$
C.c(H+)•c(OH-) D.$\frac{c(O{H}^{-})}{c({H}^{+})}$
(2)取10mL的乙溶液,加入等体积的水,醋酸的电离平衡向右(填“向左”、“向右”或“不”)移动;另取10mL的乙溶液,加入少量无水醋酸钠固体(假设加入固体前后,溶液体积保持不变),待固体溶解后,溶液中$\frac{c({H}^{+})}{c(C{H}_{3}COOH)}$的比值将减小(填“增大”、“减小”或“无法确定”).
(3)相同条件下,取等体积的甲、乙两溶液,各稀释100倍.稀释后的溶液,其pH大小关系为:pH(甲)>pH(乙)( 填“>”、“<”或“=”).
(4)取等体积的甲、乙两溶液,分别用等浓度的NaOH稀溶液中和,则消耗的NaOH溶液的体积大小关系为:V(甲)< V(乙)( 填“>”、“<”或“=”).
(5)已知25℃时,两种酸的电离平衡常数如下:
下列四种离子结合H+能力最强的是B.
A.HCO3- B.CO32- C.ClO- D.CH3COO-
写出下列反应的离子方程式:
CH3COOH+Na2CO3(少量):2CH3COOH+CO32-=H2O+2CH3COO-+CO2↑;HClO+Na2CO3(少量):HClO+CO32-=ClO-+HCO3-.
(1)常温下0.1mol/L的CH3COOH溶液加水稀释过程,下列表达式的数据一定变小的是A.
A.c(H+) B.$\frac{c({H}^{+})}{c(C{H}_{3}COOH)}$
C.c(H+)•c(OH-) D.$\frac{c(O{H}^{-})}{c({H}^{+})}$
(2)取10mL的乙溶液,加入等体积的水,醋酸的电离平衡向右(填“向左”、“向右”或“不”)移动;另取10mL的乙溶液,加入少量无水醋酸钠固体(假设加入固体前后,溶液体积保持不变),待固体溶解后,溶液中$\frac{c({H}^{+})}{c(C{H}_{3}COOH)}$的比值将减小(填“增大”、“减小”或“无法确定”).
(3)相同条件下,取等体积的甲、乙两溶液,各稀释100倍.稀释后的溶液,其pH大小关系为:pH(甲)>pH(乙)( 填“>”、“<”或“=”).
(4)取等体积的甲、乙两溶液,分别用等浓度的NaOH稀溶液中和,则消耗的NaOH溶液的体积大小关系为:V(甲)< V(乙)( 填“>”、“<”或“=”).
(5)已知25℃时,两种酸的电离平衡常数如下:
| 化学式 | CH3COOH | H2CO3 | HClO |
| 电离平衡常数K1 | 1.8×10-5 | 4.3×10-7 | 3.0×10-8 |
| K2 | -- | 5.6×10-11 | -- |
A.HCO3- B.CO32- C.ClO- D.CH3COO-
写出下列反应的离子方程式:
CH3COOH+Na2CO3(少量):2CH3COOH+CO32-=H2O+2CH3COO-+CO2↑;HClO+Na2CO3(少量):HClO+CO32-=ClO-+HCO3-.

 .
.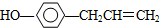 ,下列叙述中正确的是A(填序号)
,下列叙述中正确的是A(填序号)