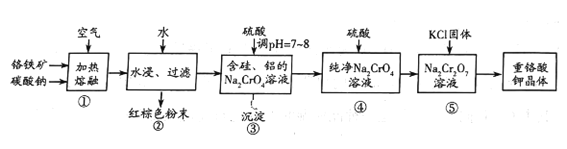
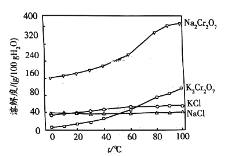
题目内容
【题目】卤素化学丰富多彩,能形成卤化物、卤素互化物、多卤化物等多种类型的化合物。
(1)卤素互化物如IBr、ICl等与卤素单质结构相似、性质相近。Cl2、IBr、ICl沸点由髙到低的顺序为___,I和Cl相比,电负性较大的是___。
(2)碘原子价电子的电子排布图为___。
(3)I3+属于多卤素阳离子,推测 I3+的空间构型为___,中心I原子的杂化轨道类型为___。
(4)请推测①HClO4、②HIO4、③H5IO6[可写成(HO)5IO]三种物质的酸性由强到弱的顺序为___(填序号)。
(5)离子化合物RbICl2存在复合阴离子,且晶体结构与NaCl相似,晶胞边长为685.5pm(1pm=10-12m),RbICl2晶胞中含有___个氯原子,RbICl2晶体的密度是___gcm-3(只要求列算式,不必计算出数值, 阿伏伽德罗常数为NA)。
(6)三氯化铁常温下为固体,熔点282℃,沸点315℃,在300℃以上易升华。易溶于 水,也易溶于乙醚、丙酮等有机溶剂。据此判断三氯化铁晶体为____。
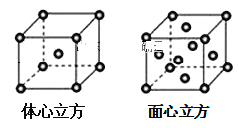
(7)金属铁的晶体在不同温度下有两种堆积方式,晶胞分别如图所示。面心立方晶胞和体心立方晶胞中实际含有的铁原子个数之比为___。
【答案】BrI>ICl>Cl2 Cl ![]() V形 sp3 ①②③ 8
V形 sp3 ①②③ 8 ![]() 分子晶体 2:1
分子晶体 2:1
【解析】
⑴利用相对分子质量越大,范德华力越大,分子晶体沸点越高;同主族元素的电负性从上到下依次递减;
⑵先写价电子电子排布式,再写价电子排布图;
⑶用价层电子互斥理论计算I的价层电子对数,得出VSEPR模型和杂化类型,去掉孤电子对得空间构型;
⑷利用同主族从上到下最高价含氧酸酸性的变化规律和非羟基氧分析;
⑸结合氯化钠晶胞分析并进行计算;
⑹根据熔沸点和溶解性分析;
⑺用均摊法分析计算。
⑴Cl2、IBr、ICl,相对分子质量越大,范德华力越大,沸点越高,因此沸点由髙到低的顺序为IBr > ICl > Cl2,同主族元素的电负性从上到下依次递减,I和Cl相比,电负性较大的是Cl,
故答案为IBr > ICl > Cl2;Cl;
⑵碘原子价电子排布式是5s25p5,其电子排布图为![]() ,
,
故答案为![]() ;
;
⑶I3+中中心原子I的价层![]() ,VSEPR模型为四面体形,有两对孤电子对,因此I3+的空间构型为V形,中心I原子的杂化轨道类型为sp3,
,VSEPR模型为四面体形,有两对孤电子对,因此I3+的空间构型为V形,中心I原子的杂化轨道类型为sp3,
故答案为V形;sp3;
⑷同主族从上到下最高价氧化物对应的水化物酸性依次减弱,故酸性① > ②, HIO4中非羟基氧有3个,H5IO6的非羟基氧有1个,按照非羟基氧个数越多酸性越强,故酸性② > ③,三种物质的酸性由强到弱的顺序为① > ②> ③;
故答案为① > ②> ③;
⑸离子化合物RbICl2存在复合阴离子,且晶体结构与NaCl相似,氯化钠晶胞中有4个氯离子,4个钠离子,因此离子化合物RbICl2有4个阳离子,有4个阴离子,即RbICl2晶胞中含有8个氯原子,晶胞边长为685.5pm(1pm=10-12m),RbICl2晶体的密度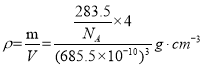 =
=![]() g/cm3,
g/cm3,
故答案为8;![]() ;
;
⑹三氯化铁常温下为固体,熔点282℃,沸点315℃,在300℃以上易升华,易溶于水,也易溶于乙醚、丙酮等有机溶剂。根据熔沸点和相似相溶性质,三氯化铁晶体为分子晶体,
故答案为分子晶体;
⑺金属铁面心立方晶胞个数为![]()
金属铁体心立方晶胞个数为![]()
因此它在晶体中实际含有的铁原子个数之比为2:1,
故答案为2:1。

 口算题卡北京妇女儿童出版社系列答案
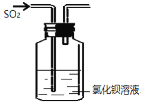
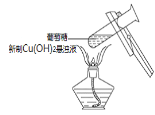
口算题卡北京妇女儿童出版社系列答案【题目】下列实验操作对应的现象不符合事实的是
|
|
|
|
A.少量二氧化硫通入氯化钡溶液中,产生白色沉淀亚硫酸钡 | B.在新制Cu(OH)2悬浊液中加入少量的葡萄糖,加热,产生砖红色沉淀 | C.将少量钠投入到无水乙醇中,钠表面有气泡产生 | D.在盛水的烧杯中加入氯化钠固体,小灯泡会逐渐亮起来 |
A. AB. BC. C...D. D