题目内容
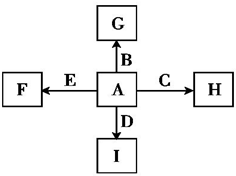 如图所示中,A、B、C、D、E是单质,G、H、I、F是B、C、D、E分别和A形成的二元化合物.已知:
如图所示中,A、B、C、D、E是单质,G、H、I、F是B、C、D、E分别和A形成的二元化合物.已知:①反应C+G
| ||
②I是一种常见的温室气体,它和E可以发生反应:
2E+I
| ||
(1)①中反应的化学方程式为
2Al+Fe2O3
2Fe+Al2O3
| ||
2Al+Fe2O3
2Fe+Al2O3
;
| ||
(2)化合物I的电子式为
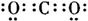
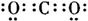
直线形
直线形
;(3)1.6g G 溶于盐酸,得到的溶液与铜粉完全反应,计算至少所需铜粉的质量(写出离子方程式和计算过程).
(4)C与过量NaOH溶液反应的离子方程式为
2Al+2OH-+2H2O═2AlO2-+3H2↑
2Al+2OH-+2H2O═2AlO2-+3H2↑
,反应后溶液与过量化合物I反应的离子方程式为AlO2-+CO2+2H2O═Al(OH)3↓+HCO3-
AlO2-+CO2+2H2O═Al(OH)3↓+HCO3-
.分析:A、B、C、D、E是单质,G、H、I、F是B、C、D、E分别和A形成的二元化合物,
①反应C+G
B+H能放出大量的热,该反应曾应用于铁轨的焊接;判断为铝热反应,所以C为Al,G为铁的氧化物Fe2O3,B为Fe,结合转化关系得到A为O2,H为Al2O3,②I是一种常见的温室气体,判断为二氧化碳;和E点燃条件下发生反应生成F和D,2E+I=2F+D为置换反应,推断E为金属单质Mg,发生的反应为,2Mg+CO2
2MgO+C,F为MgO,D为单质C;MgO中的镁元素的质量分数为60%,结合对应物质的性质以及题目要求可解答该题.
①反应C+G
| 高温 |
| ||
解答:解:A、B、C、D、E是单质,G、H、I、F是B、C、D、E分别和A形成的二元化合物,①反应C+G
B+H能放出大量的热,该反应曾应用于铁轨的焊接;判断为铝热反应,所以C为Al,G为铁的氧化物Fe2O3;结合转化关系得到A为O2,H为Al2O3,②I是一种常见的温室气体,判断为二氧化碳;和E点燃条件下发生反应生成F和D,2E+I=2F+D为置换反应,推断E为金属单质Mg,发生的反应为,2Mg+CO2
2MgO+C,F为MgO,D为单质C;MgO中的镁元素的质量分数为60%,
(1)①中反应的化学方程式为:2Al+Fe2O3
2Fe+Al2O3,
故答案为:2Al+Fe2O3
2Fe+Al2O3;
(2)二氧化碳分子是直线形化合物,碳原子和氧原子间形成两对共用电子对,分别形成两个共价键;电子式是把原子最外层电子标注在元素符号周围,二氧化碳的电子式为: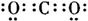 ,
,
故答案为: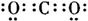 ;直线形;
;直线形;
(3)1.6g G 溶于盐酸,发生的反应为:Fe2O3+6HCl═2FeCl3+3H2O,得到的溶液与铜粉完全反应,1.6g G 为Fe2O3物质的量为0.01mol,含Fe3+离子物质的量为0.02mol;溶解铜发生反应的离子方程式为:2Fe3++Cu═2Fe2++Cu2+;至少需要的铜物质的量为0.01mol,铜的质量为0.64g,
答:反应的离子方程式为2Fe3++Cu═2Fe2++Cu2+,铜粉的质量为0.64g;
(4)C为Al与过量NaOH溶液反应的离子方程式为:2Al+2OH-+2H2O═2AlO2-+3H2↑,反应后溶液为偏铝酸钠溶液与过量化合物Ⅰ(CO2)反应生成氢氧化铝沉淀和碳酸氢钠,反应的离子方程式为:AlO2-+CO2+2H2O═Al(OH)3↓+HCO3-,
故答案为:2Al+2OH-+2H2O═2AlO2-+3H2↑;AlO2-+CO2+2H2O═Al(OH)3↓+HCO3-;
| 高温 |
| ||
(1)①中反应的化学方程式为:2Al+Fe2O3
| ||
故答案为:2Al+Fe2O3
| ||
(2)二氧化碳分子是直线形化合物,碳原子和氧原子间形成两对共用电子对,分别形成两个共价键;电子式是把原子最外层电子标注在元素符号周围,二氧化碳的电子式为:
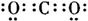 ,
,故答案为:
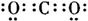 ;直线形;
;直线形;(3)1.6g G 溶于盐酸,发生的反应为:Fe2O3+6HCl═2FeCl3+3H2O,得到的溶液与铜粉完全反应,1.6g G 为Fe2O3物质的量为0.01mol,含Fe3+离子物质的量为0.02mol;溶解铜发生反应的离子方程式为:2Fe3++Cu═2Fe2++Cu2+;至少需要的铜物质的量为0.01mol,铜的质量为0.64g,
答:反应的离子方程式为2Fe3++Cu═2Fe2++Cu2+,铜粉的质量为0.64g;
(4)C为Al与过量NaOH溶液反应的离子方程式为:2Al+2OH-+2H2O═2AlO2-+3H2↑,反应后溶液为偏铝酸钠溶液与过量化合物Ⅰ(CO2)反应生成氢氧化铝沉淀和碳酸氢钠,反应的离子方程式为:AlO2-+CO2+2H2O═Al(OH)3↓+HCO3-,
故答案为:2Al+2OH-+2H2O═2AlO2-+3H2↑;AlO2-+CO2+2H2O═Al(OH)3↓+HCO3-;
点评:本题考查无机物的推断,为高考常见题型,侧重于学生的分析能力和综合应用元素化合物的能力,涉及的知识面广,题型多样,变化复杂,条件隐蔽,容易出错,是一种既考查知识,又考查能力的题型.解题的关键是在审题的基础上找准解题的突破口.经过分析,归纳,推理,得出正确的答案.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目

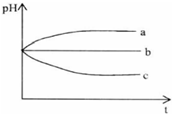 (2012?上饶一模)将pH相同的三种酸性溶液露置于空气中一段时间后,溶液的pH随时间的变化情况如图所示:则a、b、c三种溶液分别可能为( )
(2012?上饶一模)将pH相同的三种酸性溶液露置于空气中一段时间后,溶液的pH随时间的变化情况如图所示:则a、b、c三种溶液分别可能为( ) 高氯酸钾广泛用于火箭及热电池业.实验室制取高氯酸钾的原理与苏教版《实验化学》中“硝酸钾晶体的制备”相同,步骤为:称取一定质量的KCl、NaClO4加热溶解,经冷却结晶、过滤、滤出晶体用蒸馏水多次洗涤及真空干燥得到.
高氯酸钾广泛用于火箭及热电池业.实验室制取高氯酸钾的原理与苏教版《实验化学》中“硝酸钾晶体的制备”相同,步骤为:称取一定质量的KCl、NaClO4加热溶解,经冷却结晶、过滤、滤出晶体用蒸馏水多次洗涤及真空干燥得到.