题目内容
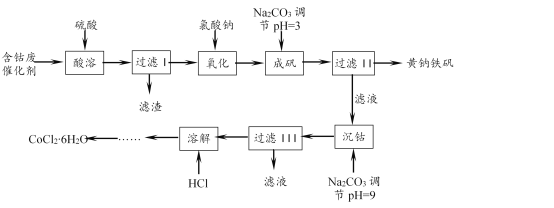
【题目】一种以含钴废催化剂(含Co、Fe、FeO、Fe2O3以及不溶于酸的杂质)制备氯化钴晶体与黄钠铁矾[Na2Fe6(SO4)4(OH)12]的工艺如下:
已知:KMnO4的氧化性强,可以氧化HBr、HCl、Fe2+等。
(1)“氧化”“成矾”需在加热条件下进行。“氧化”时反应的离子方程式为____。实验中能否选用KMnO4溶液检验Fe2+是否完全氧化,____(填“能”或“不能”),理由是____。
(2)该条件下,若用H2O2作氧化剂,实际H2O2的用量比理论用量要多,重要原因之一是H2O2发生了分解。该条件下H2O2分解较快的原因是:① ____;②____。
(3)成矾过程中反应的离子方程式为____。检验成矾是否完全的实验操作是____。
【答案】6Fe2+ + ClO3- + 6H+ ![]() 6Fe3+ + Cl- + 3H2O 否 反应后的溶液中有Cl-和H+,也会使KMnO4溶液褪色 温度升高,H2O2分解速率加快 Fe2+的催化作用使H2O2分解速率加快(或答Fe3+的催化作用) 2Na+ + 6Fe3+ + 4SO42- + 6CO32- + 6H2O
6Fe3+ + Cl- + 3H2O 否 反应后的溶液中有Cl-和H+,也会使KMnO4溶液褪色 温度升高,H2O2分解速率加快 Fe2+的催化作用使H2O2分解速率加快(或答Fe3+的催化作用) 2Na+ + 6Fe3+ + 4SO42- + 6CO32- + 6H2O ![]() Na2Fe6(SO4)4(OH)12 + 6CO2 取上层清液,向其中加入KSCN溶液,若溶液不变红,则已成矾完全
Na2Fe6(SO4)4(OH)12 + 6CO2 取上层清液,向其中加入KSCN溶液,若溶液不变红,则已成矾完全
【解析】
根据流程中发生的理化变化、结合物质的性质、应用化学反应原理解答问题。
(1)含钴废催化剂经“酸溶”、“过滤I”所得滤液中有FeSO4、Fe2(SO4)3等,而“过滤II”所得黄钠铁矾[Na2Fe6(SO4)4(OH)12]中铁为+3价。故“氧化”是将Fe2+变成Fe3+,反应的离子方程式为6Fe2+ + ClO3- + 6H+ ![]() 6Fe3+ + Cl- + 3H2O。“氧化”后溶液中有Cl-和H+,能使KMnO4溶液褪色,故不能用KMnO4溶液检验Fe2+是否完全氧化。
6Fe3+ + Cl- + 3H2O。“氧化”后溶液中有Cl-和H+,能使KMnO4溶液褪色,故不能用KMnO4溶液检验Fe2+是否完全氧化。
(2)用H2O2氧化Fe2+时,H2O2分解较快。从影响反应速率的因素分析原因:“氧化”在加热条件下进行,温度升高,H2O2分解速率加快; Fe2+或Fe3+的催化作用使H2O2分解速率加快。
(3)“成矾”时生成黄钠铁矾[Na2Fe6(SO4)4(OH)12],其中Fe3+ 、SO42- 来自氧化后的溶液、Na+ 来自NaClO3和Na2CO3、OH-只能来自CO32-水解。反应的离子方程式为 2Na+ + 6Fe3+ + 4SO42- + 6CO32- + 6H2O ![]() Na2Fe6(SO4)4(OH)12↓ + 6CO2↑。检验“成矾”是否完全,即检验成矾时Fe3+是否完全沉淀。实验操作是:取上层清液,向其中加入KSCN溶液,若溶液不变红,则成矾已完全。
Na2Fe6(SO4)4(OH)12↓ + 6CO2↑。检验“成矾”是否完全,即检验成矾时Fe3+是否完全沉淀。实验操作是:取上层清液,向其中加入KSCN溶液,若溶液不变红,则成矾已完全。