题目内容
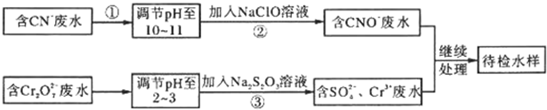
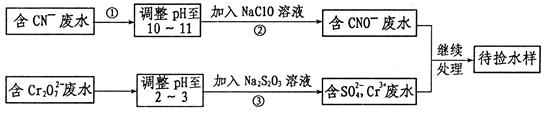
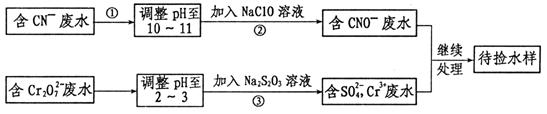
某工业废水中含有CN-和Cr2O 等离子,需经污水处理达标后才能排放,污水处理厂拟用下列流程进行处理:
等离子,需经污水处理达标后才能排放,污水处理厂拟用下列流程进行处理:

回答下列问题:
(1)步骤②中,CN-被ClO-氧化为CNO-的离子方程式为________________。
(2)步骤③的反应为S2O32-+Cr2O72-+H+ SO42-+Cr3++H2O(未配平),则每消耗0.4mol Cr2O72-转移__________mol
e-。
SO42-+Cr3++H2O(未配平),则每消耗0.4mol Cr2O72-转移__________mol
e-。
(3)含Cr3+废水可以加入熟石灰进一步处理,目的是____________________。
(4)在25℃下,将amol/L的NaCN溶液与0.01mol/L的盐酸等体积混合,反应后测得溶液pH=7,则a________0.01(填“>”、“<”或“=”);用含a的代数式表示HCN的电离常数Ka=_________________。
(5)取工业废水水样于试管中,加入NaOH溶液观察到有蓝色沉淀生成,继续加至不再产生蓝色沉淀为止,再向溶液中加入足量Na2S溶液,蓝色沉淀转化成黑色沉淀。该过程中反应的离子方程是________。
(1)CN-+ClO-=CNO-+Cl-(2分) (2) 2.4(2分)
(3)调节废水pH,使其转化成Cr(OH)3沉淀除去(2分,其它合理答案均给分)
(4)>(2分) (100a-1)×10-7 mol·L-1(2分,单位不写也给分)
(5)Cu2++2OH-=Cu(OH)2↓(2分),
Cu(OH)2(s)+S2-(aq)=CuS(s)+2OH-(aq)(2分,不注明状态也给分)
【解析】
试题分析:(1)步骤②中,CN-被ClO-氧化为CNO-,因为是在碱性环境中,所以ClO-只能被还原为Cl-,因此反应的离子方程式为CN-+ClO-=CNO-+Cl-。
(2)根据方程式可知,在反应中Cr元素的化合价从+6价降低到+3价,得到3个电子,所以0.4 mol Cr2O72-转化为Cr3+时转移电子的物质的量=0.4mol×(6-3)×2=2.4mol。
(3)熟石灰是强碱,溶于水显碱性,所以含Cr3+废水中加入熟石灰进一步处理的目的是调节废水pH,使其转化成Cr(OH)3沉淀除去。
(4)NaCN与盐酸反应生成HCN和氯化钠,反应后测得溶液pH=7,这说明NaCN过量,因此a>mol/L。根据电荷守恒c(Na+)+c(H+)=c(OH-)+c(Cl-)+c(CN-)和物料守恒c(Na+)=c(CN-)+c(HCN)可知,c(HCN)=c(Cl-)=0.005mol/L,c(CN-)=0.5amol/L-0.005mol/L,所以该温度下HCN的电离常数Ka=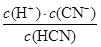 =
=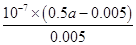 =(100a-1)×10-7 mol·L-1。
=(100a-1)×10-7 mol·L-1。
(5)蓝色沉淀为Cu(OH)2,CuS(s)比Cu(OH)2(s)更难溶,发生了沉淀的转化,所以反应的化学方程式为Cu2++2OH-=Cu(OH)2↓、Cu(OH)2(s)+S2-(aq)=CuS(s)+2OH-(aq)。
考点:考查氧化还原反应及离子方程式的书写,水溶液中的离子平衡、离子浓度、电离常数、沉淀溶解平衡等电解质溶液的相关知识