��Ŀ����
��ͭ����Ҫ�ɷ�CuFeS2������ȡͭ����Ҫԭ��
��1��ȡ12.5g��ͭ����Ʒ�����ⶨ��3.60g�����ʲ�����������CuFeS2����Ϊ______��
��2����֪2CuFeS2+4O2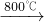 Cu2S+3SO2+2FeO��¯��������Cu2S��1200������¼�����Ӧ��2Cu2S+3O2��2Cu2O+2SO2��2Cu2O+Cu2S��6Cu+SO2��
Cu2S+3SO2+2FeO��¯��������Cu2S��1200������¼�����Ӧ��2Cu2S+3O2��2Cu2O+2SO2��2Cu2O+Cu2S��6Cu+SO2��
�ٶ�������Ӧ����ȫ��������м��㣺
����6mol CuFeS2����6mol Cu��������O2�����ʵ���______��
��6mol CuFeS2��14.25mol O2��Ӧ�������Ͽɵõ�______Ħ��ͭ��
��6mol CuFeS2��15.75mol O2��Ӧ�������Ͽɵõ�______Ħ��ͭ��
�⣺��1��12.5g���أ�CuFeS2���� =3.6g����æأ�CuFeS2��=82.8%��
=3.6g����æأ�CuFeS2��=82.8%��
�ʴ�Ϊ��82.8%��
��2�����ɷ�Ӧ��֪������CuFeS2��O2��Ӧ�����ճ�ΪFeO��Cu��SO2������ԭ���غ�n��FeO��=n��CuFeS2��=6mol��n��SO2��=2n��CuFeS2��=mol������Oԭ���غ��֪2n��O2��=n��FeO��+2n��SO2��=6mol+12mol��2����n��O2��=15mol��
�ʴ�Ϊ��15��
��2CuFeS2+4O2=Cu2S+3SO2+2FeO
6mol 12mol 3mol
��ʣ������Ϊ14.25mol-12mol=2.25mol������Cu2SΪ3mol��
2Cu2S+3O2=2Cu2O+2SO2��
3mol 4.5mol
���������㣬��������ȫ��Ӧ������Cu2OΪ2.25mol�� =1.5mol��ʣ��Cu2SΪ3mol-1.5mol=1.5mol��
=1.5mol��ʣ��Cu2SΪ3mol-1.5mol=1.5mol��
2Cu2O+Cu2S=6Cu+SO2��
1.5mol 0.75mol
��������ͭ��ȫ��Ӧ������ͭ1.5mol�� =4.5mol��
=4.5mol��
�ʴ�Ϊ��4.5��
��2CuFeS2+4O2=Cu2S+3SO2+2FeO
6mol 12mol 3mol
��ʣ������Ϊ15.75mol-12mol=3.75mol������Cu2SΪ3mol��
2Cu2S+3O2=2Cu2O+2SO2��
3mol 4.5mol
���������㣬��������ȫ��Ӧ������Cu2OΪ3.75mol�� =2.5mol��ʣ��Cu2SΪ3mol-2.5mol=0.5mol��
=2.5mol��ʣ��Cu2SΪ3mol-2.5mol=0.5mol��
2Cu2O+Cu2S=6Cu+SO2��
1mol 0.5mol
��������ͭ��ʣ�࣬����ͭ0.5mol��6=3mol��
�ʴ�Ϊ��3��
��������1��m����Ʒ�����أ�CuFeS2����CuFeS2��SԪ�ص���������=m��S����
��2�����ɷ�Ӧ��֪������CuFeS2��O2��Ӧ�����ճ�ΪFeO��Cu��SO2������ԭ���غ����n��FeO����n��SO2��������Oԭ���غ��֪2n��O2��=n��FeO��+n��SO2����
�ڢ۸��ݷ���ʽ����6mol CuFeS2����O2�����ʵ���������Cu2S�����ʵ�������������ʣ��O2�����ʵ���������2Cu2S+3O2=2Cu2O+2SO2���㷴Ӧ��Cu2S�����ʵ���������Cu2O�����ʵ�������������ʣ��Cu2S�����ʵ������ٸ���2Cu2O+Cu2S��6Cu+SO2���й������㣮
���������⿼��������йؼ��㣬��Ŀ���̸��ӣ��������ܴ�Ϊ�״���Ŀ����ѧ�������������нϸߵ�Ҫ��ע��ԭ���غ������������㣮
 =3.6g����æأ�CuFeS2��=82.8%��
=3.6g����æأ�CuFeS2��=82.8%���ʴ�Ϊ��82.8%��
��2�����ɷ�Ӧ��֪������CuFeS2��O2��Ӧ�����ճ�ΪFeO��Cu��SO2������ԭ���غ�n��FeO��=n��CuFeS2��=6mol��n��SO2��=2n��CuFeS2��=mol������Oԭ���غ��֪2n��O2��=n��FeO��+2n��SO2��=6mol+12mol��2����n��O2��=15mol��
�ʴ�Ϊ��15��
��2CuFeS2+4O2=Cu2S+3SO2+2FeO
6mol 12mol 3mol
��ʣ������Ϊ14.25mol-12mol=2.25mol������Cu2SΪ3mol��
2Cu2S+3O2=2Cu2O+2SO2��
3mol 4.5mol
���������㣬��������ȫ��Ӧ������Cu2OΪ2.25mol��
 =1.5mol��ʣ��Cu2SΪ3mol-1.5mol=1.5mol��
=1.5mol��ʣ��Cu2SΪ3mol-1.5mol=1.5mol��2Cu2O+Cu2S=6Cu+SO2��
1.5mol 0.75mol
��������ͭ��ȫ��Ӧ������ͭ1.5mol��
 =4.5mol��
=4.5mol���ʴ�Ϊ��4.5��
��2CuFeS2+4O2=Cu2S+3SO2+2FeO
6mol 12mol 3mol
��ʣ������Ϊ15.75mol-12mol=3.75mol������Cu2SΪ3mol��
2Cu2S+3O2=2Cu2O+2SO2��
3mol 4.5mol
���������㣬��������ȫ��Ӧ������Cu2OΪ3.75mol��
 =2.5mol��ʣ��Cu2SΪ3mol-2.5mol=0.5mol��
=2.5mol��ʣ��Cu2SΪ3mol-2.5mol=0.5mol��2Cu2O+Cu2S=6Cu+SO2��
1mol 0.5mol
��������ͭ��ʣ�࣬����ͭ0.5mol��6=3mol��
�ʴ�Ϊ��3��
��������1��m����Ʒ�����أ�CuFeS2����CuFeS2��SԪ�ص���������=m��S����
��2�����ɷ�Ӧ��֪������CuFeS2��O2��Ӧ�����ճ�ΪFeO��Cu��SO2������ԭ���غ����n��FeO����n��SO2��������Oԭ���غ��֪2n��O2��=n��FeO��+n��SO2����
�ڢ۸��ݷ���ʽ����6mol CuFeS2����O2�����ʵ���������Cu2S�����ʵ�������������ʣ��O2�����ʵ���������2Cu2S+3O2=2Cu2O+2SO2���㷴Ӧ��Cu2S�����ʵ���������Cu2O�����ʵ�������������ʣ��Cu2S�����ʵ������ٸ���2Cu2O+Cu2S��6Cu+SO2���й������㣮
���������⿼��������йؼ��㣬��Ŀ���̸��ӣ��������ܴ�Ϊ�״���Ŀ����ѧ�������������нϸߵ�Ҫ��ע��ԭ���غ������������㣮

��ϰ��ϵ�д�
�����Ŀ
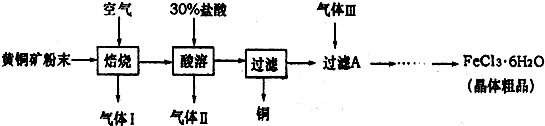


 �ɻ�ͭ����Ҫ�ɷ���CuFeS2������ұ���õ���ͭ���پ�����⾫���õ���ͭ��
�ɻ�ͭ����Ҫ�ɷ���CuFeS2������ұ���õ���ͭ���پ�����⾫���õ���ͭ��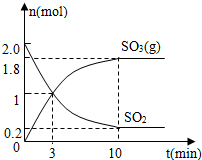 ���仯��������Ȼ���й㷺���ڣ��������ԭ���ش��������⣺
���仯��������Ȼ���й㷺���ڣ��������ԭ���ش��������⣺