题目内容
已知:金属铈(稀土元素)在空气中易氧化变暗,受热时燃烧,遇水很快反应。(注:铈常见的化合价为+3和+4,氧化性:Ce4+>Fe3+)下列说法正确的是( )
A.铈溶于氢碘酸的化学方程式可表示为Ce+4HI=CeI4+2H2↑
B.用Ce(SO4)2溶液滴定硫酸亚铁溶液,其离子方程式为:Ce4++2Fe2+=Ce3++2Fe3+
C.在一定条件下,电解熔融状态的CeO2制Ce,在阴极获得铈
D.四种铈的核素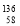 Ce、
Ce、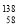 Ce、
Ce、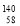 Ce、
Ce、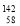 Ce,它们互称为同素异形体
Ce,它们互称为同素异形体
C
【解析】根据题中信息可知铈是一种很活泼的金属,且氧化性Ce4+>Fe3+,由于Fe3+能氧化I-,故Ce4+也能氧化I-,因此铈与氢碘酸反应不能生成Ce4+,A项错误;B项中所给方程式电荷不守恒;D项中四种核素互为同位素

练习册系列答案
相关题目




