题目内容
2.甲基、苯基、羟基、羧基四种原子团中,不同的原子团两两结合,得到的物质中具有酸性的有( )| A. | 6种 | B. | 5种 | C. | 4种 | D. | 2种 |
分析 酚(羟基与苯环直接相连)及含-COOH的物质具有酸性,以此来解答.
解答 解:由羟基、甲基、羧基、苯基四种基团中的两两结合形成的化合物有:CH3OH、H2CO3、CH3COOH、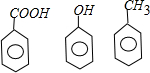 ,其水溶液呈酸性的有碳酸、乙酸、苯甲酸,苯酚,所以共有4种,故选C.
,其水溶液呈酸性的有碳酸、乙酸、苯甲酸,苯酚,所以共有4种,故选C.
点评 本题考查有机物的结构与性质,为高频考点,把握官能团与性质的关系为解答的关键,侧重酚及羧酸性质的考查,题目难度不大.

练习册系列答案
 课时训练江苏人民出版社系列答案
课时训练江苏人民出版社系列答案
相关题目
12.氢氟酸是一种弱酸,可用来刻蚀玻璃.已知25℃时
①HF(aq)+OH- (aq)=F- (aq)+H2O(l)△H=-67.7KJ•mol-1
②H+(aq)+OH- (aq)=H2O(l)△H=-57.3KJ•mol-1
在20mL0.1•molL-1氢氟酸中加入VmL0.1mol•L-1NaOH溶液,下列有关说法正确的是( )
①HF(aq)+OH- (aq)=F- (aq)+H2O(l)△H=-67.7KJ•mol-1
②H+(aq)+OH- (aq)=H2O(l)△H=-57.3KJ•mol-1
在20mL0.1•molL-1氢氟酸中加入VmL0.1mol•L-1NaOH溶液,下列有关说法正确的是( )
| A. | 氢氟酸的电离方程式及热效应可表示为:HF(aq)?H+(aq)+F-(aq)△H=+10.4 KJ•mol-1 | |
| B. | 当V=20时,溶液中:c(F-)<c(Na+)=0.1 mol?L-1 | |
| C. | 当V=20时,溶液中:c(Na+)>c(F-)>c(OH-)>c(H+) | |
| D. | 当V>0时,溶液中一定存在:c(Na+)>c(F-)>c(OH-)>c(H+) |
13.半导体生产中常需要控制掺杂,以保证控制电阻率,三氯化磷(PCl3)是一种重要的掺杂剂.实验室要用黄磷(即白磷)与干燥的Cl2在曲颈瓶中模拟工业生产制取PCl3,装置如图所示:(部分夹持装置略去)
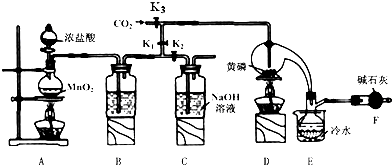
已知黄磷与少量Cl2反应生成PCl3,与过量Cl2反应生成PCl5.PCl3遇水会强烈水解生成H3PO3和HCl;遇O2会生成POCl3,POCl3溶于PCl3.PCl3、POCl3的熔沸点如表:
请回答下列问题:
(1)B中所装试剂是浓H2SO4;E中冷水的作用是冷凝PCl3防止其挥发.
(2)F中碱石灰的作用是吸收多余的氯气,防止空气中的水蒸汽进入烧瓶中和PCl3 反应.
(3)实验时,检查装置气密性后,先打开K3通入干燥的CO2,再迅速加入黄磷.通干燥CO2的作用是排尽装置中的空气,防止白磷自燃.
(4)粗产品中常含有POC13、PCl5等.加入黄磷加热除去PCl5后,通过蒸馏(填实验操作名称),即可得到较纯净的PCl3.
(5)实验结束时,可以利用C中的试剂吸收多余的氯气,C中反应的离子方程式为Cl2+2OH-=Cl-+ClO-+2H2O.
(6)通过下面方法可测定产品中PCl3的质量分数:
①迅速称取1.00g产品,加水反应后配成250mL溶液;
②取以上溶液25.00mL,向其中加入10.00mL 0.1000mol/L碘水,充分反应;
③向②所得溶液中加入几滴淀粉溶液,用0.1000mol/L的Na2S2O3,溶液滴定;
④重复②、③操作,平均消耗Na2S2O3溶液8.40mL.
已知:H3PO3+I2=H3PO4+2HI,I2+2Na2S2O3=2NaI+Na2S4O6,
根据上述数据,假设测定过程中没有其他反应,该产品中PCl3的质量分数为79.75%.

已知黄磷与少量Cl2反应生成PCl3,与过量Cl2反应生成PCl5.PCl3遇水会强烈水解生成H3PO3和HCl;遇O2会生成POCl3,POCl3溶于PCl3.PCl3、POCl3的熔沸点如表:
| 物质 | 熔点/℃ | 沸点/℃ |
| PCl3 | -112 | 75.5 |
| POCl3 | 2 | 105.3 |
(1)B中所装试剂是浓H2SO4;E中冷水的作用是冷凝PCl3防止其挥发.
(2)F中碱石灰的作用是吸收多余的氯气,防止空气中的水蒸汽进入烧瓶中和PCl3 反应.
(3)实验时,检查装置气密性后,先打开K3通入干燥的CO2,再迅速加入黄磷.通干燥CO2的作用是排尽装置中的空气,防止白磷自燃.
(4)粗产品中常含有POC13、PCl5等.加入黄磷加热除去PCl5后,通过蒸馏(填实验操作名称),即可得到较纯净的PCl3.
(5)实验结束时,可以利用C中的试剂吸收多余的氯气,C中反应的离子方程式为Cl2+2OH-=Cl-+ClO-+2H2O.
(6)通过下面方法可测定产品中PCl3的质量分数:
①迅速称取1.00g产品,加水反应后配成250mL溶液;
②取以上溶液25.00mL,向其中加入10.00mL 0.1000mol/L碘水,充分反应;
③向②所得溶液中加入几滴淀粉溶液,用0.1000mol/L的Na2S2O3,溶液滴定;
④重复②、③操作,平均消耗Na2S2O3溶液8.40mL.
已知:H3PO3+I2=H3PO4+2HI,I2+2Na2S2O3=2NaI+Na2S4O6,
根据上述数据,假设测定过程中没有其他反应,该产品中PCl3的质量分数为79.75%.
17.能提高单位体积内活化分子数,但不改变活化分子百分数的是( )
| A. | 增大反应物的浓度 | B. | 增大气体压强 | ||
| C. | 升温 | D. | 使用催化剂 |
7.常温下,下列各组离子在指定溶液中一定能大量共存的是( )
| A. | 水电离的c( H+)=1×l0-13 mol/L的溶液中:K+、Na+、SiO32-、SO42- | |
| B. | 能使石蕊呈蓝色的溶液中:Na+、Fe3+、SO42-、Cl- | |
| C. | $\frac{{K}_{W}}{c(O{H}^{-})}$=l×l0-13mol/L的溶液中:Ba2+、ClO-、Cl-、NO3- | |
| D. | 能与铝反应放出H2的溶液中:Fe2+、K+、SO42-、Cl- |
14.下列各组混合物,可以用分液漏斗分离的是( )
| A. | 甲苯和酒精 | B. | 甲苯和苯 | C. | 溴乙烷与水 | D. | 苯与溴乙烷 |
11.下列物质中,其水溶液能导电,但属于非电解质的是( )
| A. | 硫酸 | B. | Cl2 | C. | NH4NO3 | D. | NH3 |
12.质量相等的SO2和SO3,所含氧原子数之比为( )
| A. | 1:1 | B. | 2:3 | C. | 6:5 | D. | 5:6 |