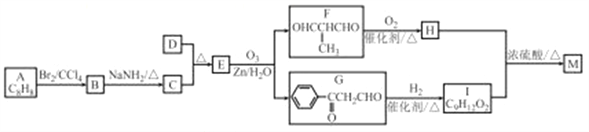
题目内容
【题目】向体积为2 L的密闭容器中充入2 mol SO2和1 mol O2,测得起始容器压强为p,一定条件下发生反应:2SO2(g)+O2(g)![]() 2SO3(g) △H=-196 kJ·mol-1,维持容器温度不变,测得平衡时容器内压强为0.7p,若此时再向容器中充入2 mol SO3,则下列说法正确的是
2SO3(g) △H=-196 kJ·mol-1,维持容器温度不变,测得平衡时容器内压强为0.7p,若此时再向容器中充入2 mol SO3,则下列说法正确的是
A. 充入2 mol SO3后,SO2的物质的量增大
B. 第一次反应达到平衡时共放出热量176.4 kJ
C. 充入2 mol SO3达到新平衡时,容器内的压强为1.4p
D. 降低容器的温度可使新平衡时各物质的体积分数与第一次平衡时相同
【答案】AB
【解析】正确答案:AB
A、正确,相当于两个全等的容器,加压后合并到一个容器中,平衡正向移动,,但转化率达不到100%,SO2的物质的量介于原平衡的1倍到2倍之间;C.不正确,充入2 mol SO3达到新平衡时,容器内的压强小于1.4p
B、正确,
2L: 2SO2(g)+O2(g)![]() 2SO3(g)
2SO3(g)
n始 2 1
n变 -2x -x +2x
n平 2-2x 1-x 2x
PV=nRT 其它条件相同时,物质的量之比等于压强之比
![]() x=0.9mol
x=0.9mol
196kJ/mol×0.9mol=176.4kJ
D、温度改变,平衡常数改变。

【题目】亚硝酸为弱酸,其钠盐(亚硝酸钠NaNO2)外观酷似食盐且有咸味,过量使用会使人中毒。其银盐不溶于水。某化学兴趣小组对亚硝酸钠的制备进行了探究。
(1)请设计一种简单方法鉴别NaCl和NaNO2 :___________。
(2)利用如图完成一氧化氮与过氧化钠反应制备业硝酸钠。查阅资料:2NO + Na2O2 =2NaNO2, 2NO2+ Na2O2=2NaNO3, NO 能被酸性高锰酸钾氧化为NO3-。回答下列问题:
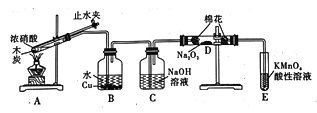
① 检查装置气密性后,应进行的操作是_________。
② 装置B 中Cu 参与反应的离子方程式为______,装置C 的作用是______。
③ 装置E发生反应的离子方程式为________。
④ 同学们经过讨论认为上述装置仍然存在缺陷,D中生成的产物不纯,D管中可能含有的杂质为________(填化学式),你认为应该进行的改进是__________。
(3)测定制取样品中NaNO2的纯度。
步骤:a.在5个有编号的带刻度的试管中分别加入不同体积、相同浓度的NaNO2溶液,各加入1mL的M溶液(M遇NaNO2呈紫红色,NaNO2浓度越大颜色越深),再加蒸馏水至总体积均为10mL,并振荡,制成标准色阶;
试管编号 | ① | ② | ③ | ④ | ⑤ |
NaNO2含量(mg/L) | 0 | 20 | 40 | 60 | 80 |
b.称量0.10g制得的样品,溶于水配成500mL溶液。取5mL待测液,加入1mLM,再加入蒸馏水至l0mL,并振荡,与标准色阶比较。
比较结果:待测液与④标准色阶相同,则制取样品中NaNO2的纯度是________。
查阅资料可知:维生素C可有效降低NaNO2的含量。请完成下列实验验证方案:取5 mL 待测液,加入______,振荡,再加入1mL M溶液,_____,再振荡,与④ 标准色阶对比。实验现象为紫红色比④ 标准色阶浅,则证明维生素C可以有效降低NaNO2的含量。