题目内容
纯Na2CO3 m g与20mL盐酸恰好完全反应生成正盐,则此盐酸的物质的量浓度为 mol/L.若上述Na2CO3不纯,杂质可能是K2CO3、NaCl和NaOH中某一种,当用上述盐酸反应时,所用盐酸体积大于20mL,则其中所含杂质可能是 .
考点:化学方程式的有关计算
专题:计算题
分析:mg纯Na2CO3 的物质的量为:
=
mol,根据反应的化学方程式Na2CO3+2HCl=2NaCl+CO2↑+H2O可以计算出mg碳酸钠完全反应消耗HCl的物质的量,然后根据c=
计算出盐酸的物质的量浓度;所用盐酸体积大于20mL,说明等质量时杂质消耗的HCl比碳酸钠消耗的HCl的量大,然后根据K2CO3、NaCl消耗的盐酸比碳酸钠少,NaOH比碳酸钠消耗的盐酸多得出正确结论.
| mg |
| 106g/mol |
| m |
| 106 |
| n |
| V |
解答:
解:纯Na2CO3 m g与20mL盐酸恰好完全反应生成正盐,反应的化学方程式为:Na2CO3+2HCl=2NaCl+CO2↑+H2O,反应消耗的HCl的物质的量为:n(HCl)=2n(Na2CO3)=2×
=
mol,
则此盐酸的物质的量浓度为:c(HCl)=
=
mol/L;
Na2CO3不纯,杂质可能是K2CO3、NaCl和NaOH中某一种,当用上述盐酸反应时,所用盐酸体积大于20mL,说明等物质的量的条件下,杂质消耗的盐酸大于消耗的盐酸Na2CO3,
根据反应方程式K2CO3+2HCl=2KCl+CO2↑+H2O可知,Na2CO3与K2CO3消耗盐酸的物质的量关系相同,由于K2CO3的摩尔质量大于Na2CO3,则等物质的量时K2CO3消耗的盐酸体积偏小,即:杂质为K2CO3时,消耗的盐酸体积小于20mL,所以K2CO3不符合条件;
NaCl不与盐酸反应,所以含有杂质氯化钠时,消耗的盐酸体积小于20mL,所以NaCl也不符合要求;
当杂质为NaOH时,NaOH与HCl反应的方程式为:NaOH+HCl=NaCl+H2O,设质量都是106g,106gK2CO3消耗2molHCl,而106gNaOH消耗HCl的物质的量为:
=
mol>2mol,即:杂质为NaOH时消耗的盐酸体积大于20mL,所以杂质为NaOH符号条件,
故答案为:
;NaOH.
| mg |
| 106g/mol |
| m |
| 53 |
则此盐酸的物质的量浓度为:c(HCl)=
| ||
| 20×10-3L |
| 50m |
| 53 |
Na2CO3不纯,杂质可能是K2CO3、NaCl和NaOH中某一种,当用上述盐酸反应时,所用盐酸体积大于20mL,说明等物质的量的条件下,杂质消耗的盐酸大于消耗的盐酸Na2CO3,
根据反应方程式K2CO3+2HCl=2KCl+CO2↑+H2O可知,Na2CO3与K2CO3消耗盐酸的物质的量关系相同,由于K2CO3的摩尔质量大于Na2CO3,则等物质的量时K2CO3消耗的盐酸体积偏小,即:杂质为K2CO3时,消耗的盐酸体积小于20mL,所以K2CO3不符合条件;
NaCl不与盐酸反应,所以含有杂质氯化钠时,消耗的盐酸体积小于20mL,所以NaCl也不符合要求;
当杂质为NaOH时,NaOH与HCl反应的方程式为:NaOH+HCl=NaCl+H2O,设质量都是106g,106gK2CO3消耗2molHCl,而106gNaOH消耗HCl的物质的量为:
| 106g |
| 40g/mol |
| 53 |
| 20 |
故答案为:
| 50m |
| 53 |
点评:本题考查了有关物质的量浓度的计算、利用化学方程式的计算,题目难度中等,注意掌握物质的量与摩尔质量、物质的量浓度之间的转化关系,第二问中需要通过讨论完成,注意掌握通过讨论法解答化学计算题的方法与技巧.

练习册系列答案
相关题目
今年全国低碳日活动的主题是:“携手节能低碳、共建碧水蓝天”.下列措施与这主题不相符的是( )
A、 焚烧废弃塑料 |
B、 处理污水 |
C、 风力发电 |
D、 推广电动汽车 |
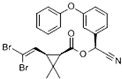 拟除虫菊酯是一类高效、低毒、对昆虫具有强烈触杀作用的杀虫剂,其中对光稳定的溴氰菊酯的结构简式如图,下列对该化合物叙述正确的是( )
拟除虫菊酯是一类高效、低毒、对昆虫具有强烈触杀作用的杀虫剂,其中对光稳定的溴氰菊酯的结构简式如图,下列对该化合物叙述正确的是( )| A、属于芳香烃 |
| B、属于卤代烃 |
| C、属于高分子化合物 |
| D、属于有机化合物 |
在乙醇发生的各种反应中,断键方式不正确的是( )
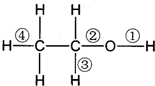

| A、与金属钠反应时,键①断裂 |
| B、与醋酸、浓硫酸共热时,键②断裂 |
| C、与浓硫酸共热至170℃时,键②和④断裂 |
| D、与HCl反应生成氯乙烷时,键②断裂 |
设NA表示阿伏伽德罗常数的值,下列说法中正确的( )
| A、常温下,42g C2H4和C4H8的混合物中含有的碳原子数为3NA |
| B、58.5g氯化钠固体中含有NA个氯化钠分子 |
| C、标况下,11.2L己烷所含的分子数为0.5NA |
| D、1mol FeCl3完全水解转化为氢氧化铁胶体后生成NA个胶粒 |