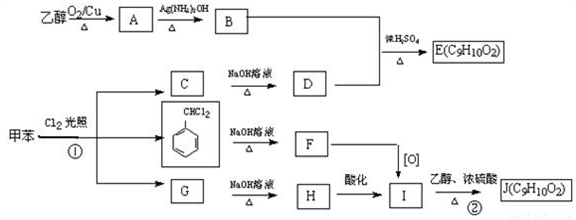
题目内容
乙炔是重要的化工原料,广泛用于有机合成和氧炔焊等。生产乙炔的方法有多种,如电石法、甲烷裂解法等。
(1)在Co(NO3)2催化下,乙炔可被50%的浓硝酸(硝酸被还原为NO2)在20~70℃时直接氧化为H2C2O4·2H2O。
①该反应的化学方程式为________________________;
②实际生产中硝酸可循环利用而不被消耗,用方程式说明:___________________。
(2)电石法原理为:由石油焦与生石灰在电炉中生成电石CaC2(含Ca3P2、CaS等杂质), 电石与水反应生成C2H4(含PH3及H2S等杂质)。
①已知焦炭固体与氧化钙固体每生成l g CaC2固体,同时生成CO气体吸收7.25kJ的 热量,则该反应的热化学方程式为_____________________________________;
②用CuSO4溶液净化乙炔气体,去除PH3的反应之一为:4CuSO4+PH3+4H2O===4Cu↓+H3PO4+4H2SO4,每去除1 mol PH3,该反应中转移电子的物质的量为__________;
③反应H2S(aq)+Cu2+(aq)===CuS(s)+2H+(aq)的平衡常数为________________;(已知Ksp(CuS)=1.25×10-36,H2S的Kal=1×10-7,Ka2=1×10-13)
④电石法工艺流程简单、容易操作、乙炔纯度高,缺点是_______(举1例)。
(3)甲烷裂解法原理为:2CH4(g) C2H2(g)+3H2(g)△H,实验测得该反应的Kp(用平衡分压代替浓度计算的平衡常数,分压=总压×物质的量分数)与温度的关系如图所示:
C2H2(g)+3H2(g)△H,实验测得该反应的Kp(用平衡分压代替浓度计算的平衡常数,分压=总压×物质的量分数)与温度的关系如图所示:
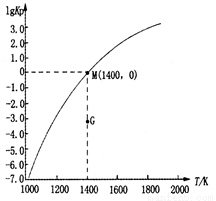
①该反应的△H________0(填“>”、“=”或“<”);
②图中G点v(正)______v(逆)(填“>”、“=”或“<”);
③M点时,若容器中气体的总物质的量为1 mol,则总压P与n(CH4)、n(C2H2)及n(H2)之间的关系为_________。
 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案下列操作及解释都正确的是
选项 | 应用 | 解释 |
A | 在相同条件下,在两支试管中各加入2 mL 5% H2O2溶液,再向H2O2溶液中分别滴入1 mL H2O和1 mL 0.1 mol·L-1 FeCl3溶液,对比观察现象 | 可以探究催化剂FeCl3对H2O2 分解速率的影响 |
B | 向盛有1mL 0.01 mol·L-1 AgNO3溶液的试管中滴加5滴0.01 mol·L-1 NaCl溶液,有白色沉淀生成,再向其中滴加0.01 mol·L-1 KI溶液,产生黄色沉淀。 | 常温下,Ksp(AgCl)> Ksp(AgI) |
C | 向两份蛋白质溶液中分别滴加饱和NaCl溶液和CuSO4溶液,均有固体析出 | 蛋白质均发生变性 |
D | 保存硫酸亚铁溶液需加入少量稀盐酸和铁钉 | 防止 Fe2+水解以及被 O2 氧化 |
A. A B. B C. C D. D




 2NH3(g)合成氮气。对于气相反应,用某组份(B)的平衡压强(PB)代替物质的量浓度(CB)也可以表示平衡常数(记作Kp),且PB=P×B的体积分数。则该反应的化学平衡常数表达式(Kp)是_____。恒温恒压下,在一容积可变的容器中,该反应达到平衡状态时,N2、H2、NH3各1mol,若此时再充入3molN2,则平衡_________移动(填“正向”、“逆向”或“不”)。
2NH3(g)合成氮气。对于气相反应,用某组份(B)的平衡压强(PB)代替物质的量浓度(CB)也可以表示平衡常数(记作Kp),且PB=P×B的体积分数。则该反应的化学平衡常数表达式(Kp)是_____。恒温恒压下,在一容积可变的容器中,该反应达到平衡状态时,N2、H2、NH3各1mol,若此时再充入3molN2,则平衡_________移动(填“正向”、“逆向”或“不”)。

 2SO2(g)+O2(g)并达到平衡;保持温度不变,再充入相同体积的SO3(g),达到新平衡后,与原平衡相比,下列值减小的是 ( )
2SO2(g)+O2(g)并达到平衡;保持温度不变,再充入相同体积的SO3(g),达到新平衡后,与原平衡相比,下列值减小的是 ( )