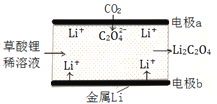
��Ŀ����
����Ŀ��ijѧ��Ϊ�ⶨδ֪Ũ�ȵ�������Һ��ʵ�����£���1��00mL������������100 mLϡH2SO4��Һ����0��14mol��L��NaOH��Һ�ζ�����ϡH2SO425mL���ζ���ֹʱ����NaOH��Һ15mL��
��1����ѧ���ñ�0��14 mol��L NaOH��Һ�ζ������ʵ��������£�
A������ʽ�ζ���ȡϡH2SO4 25 mL��ע����ƿ�У�����ָʾ����
B���ô��ⶨ����Һ��ϴ��ʽ�ζ��ܡ�
C��������ˮϴ�ɾ��ζ��ܡ�
D��ȡ�¼�ʽ�ζ����ñ���NaOH��Һ��ϴ����Һע���ʽ�ζ��̶ܿȡ�0������2��3 cm�����ٰѼ�ʽ�ζ��̶ܹ��ã�����Һ�����̶ȡ�0����0���̶����¡�
E�����ζ����Ƿ�©ˮ��
F����ȡ��ƿ�����ظ�����һ�Ρ�
G������ƿ���ڵζ������棬ƿ�µ�һ�Ű�ֽ���ߵα�ҡ����ƿֱ���ζ��յ㣬���µζ���Һ�����ڿ̶ȡ�
�ٵζ���������ȷ˳����(�������д)��_______________��
�ڸõζ�������Ӧѡ�õ�ָʾ���ǣ�____________________��
����G���������ȷ���յ�?__________________________________��
��2����ʽ�ζ���������ˮ��ϴ��δ�ñ�Һ��ϴ���µζ����(�ƫС������ƫ��ǡ�ú��ʡ�)________��ԭ����__________________________��
��3�������������(ϡ��ǰ������)��Һ�����ʵ���Ũ��__________mol��L��������λС����
���𰸡� ECDBAGF ��̪ ���������һ��NaOH��Һ����Һ����ɫ���dz��ɫ���Ұ���Ӳ���ɫ ƫ�� �ζ����ڱ��ϵ�ˮĤ������Һϡ�ͣ�ʹ�������ƫ�� 4.20
��������(1)���ñ�0.14mol/L NaOH��Һ�ζ������ʵ���������Ϊ�����ζ����Ƿ�©ˮ��ϴ�ӵζ��ܡ���ϴ��ʢװ��Һ����ϴʢװ��Һ�ĵζ��ܡ�ʢװ��Һ����ʼ�ζ����ظ��ζ��ȣ�������ȷ�IJ���˳��Ϊ��ECDBAGF���ʴ�Ϊ��ECDBAGF��
��������������������ǡ���кͣ���Һ��pH=7������ѡ�÷�̪(��ɫ��ΧΪ��8-10)��Ϊָʾ�����ʴ�Ϊ����̪��
�۵ζ�����ǰ�������̪��������ҺΪ��ɫ���ζ�����ʱ����Һ��ɺ�ɫ�����Եζ��յ�����Ϊ���������һ��NaOH��Һ����ҺͻȻ��ɺ�ɫ������Ӳ���ɫ���ʴ�Ϊ���������һ��NaOH��Һ����ҺͻȻ��ɺ�ɫ������Ӳ���ɫ��
(2)��ʽ�ζ���������ˮ��ϴ��δ�ñ�Һ��ϴ���൱�ڱ�Һ��ϡ�ͣ��������ĵ���ϡ����ͻ����࣬�ζ����ƫ�ʴ�Ϊ��ƫ�ζ����ڱ��ϵ�ˮĤ������Һϡ�ͣ�ʹ�������ƫ��
(3)���ݷ�Ӧ��2NaOH+H2SO4=Na2SO4+2H2O��ϡ�ͺ��������ҺŨ��Ϊ��c(H2SO4)=  =0.042mol/L��ϡ��ǰϡ�����Ũ��Ϊ��0.042mol/L��
=0.042mol/L��ϡ��ǰϡ�����Ũ��Ϊ��0.042mol/L��![]() =4.20mol/L���ʴ�Ϊ��4.20��
=4.20mol/L���ʴ�Ϊ��4.20��

 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
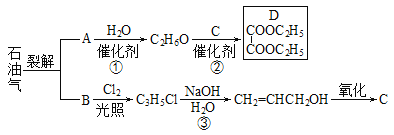
Сѧ��10����Ӧ����ϵ�д�����Ŀ��3��5-����������������Ҫ���л��ϳ��м��壬��������Ȼ���ʰ������صĺϳɡ�һ���Լ䱽����Ϊԭ�ϵĺϳɷ�Ӧ���£�

��Ӧ�������ȷ�����״����ټ������ѣ�����õ��л��㣨�������Ȼ��⣩����ϴ�ӣ�Ȼ������ᴿ�õ�����״���3��5-�����������ӵIJ����������ʼ��±�������˵����ȷ����
���� | �е�/�� | �۵�/�� | �ܽ��� |
�״� | 64. 7 | ��97.8 | ������ˮ |
3��5-������������ | 172~175 | 33~36 | �����ڼ״������ѣ�����ˮ |
A. �����ϳɷ�Ӧ����ȡ����Ӧ
B. �䱽�����뱽�ӻ�Ϊͬϵ��
C. ������״��IJ����ǽᾧ
D. ϴ��ʱ�����ñ���Na2CO3��Һ���Ȼ���