题目内容
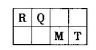
短周期元素R、T、X、Y、Z在元素周期表的相对位置如表,它们的最外层电子数之和为24.则下列判断正确的是( )
| R | T | |
| X | Y | Z |
| A、X位于元素周期表中第三周期第ⅥA族 |
| B、Z元素的气态氢化物为极性分子 |
| C、Y元素最高价氧化物对应水化物为强酸 |
| D、五种元素中原子半径最大的是R |
分析:由短周期元素R、T、X、Y、Z在元素周期表的相对位置知,R、T应在第二周期,X、Y、Z应在第三周期,设R的最外层电子数为x,则T、Y的最外层电子数为x+1,Z的最外层电子数为x+2,它们的最外层电子数之和为24,则x+x+(x+1)×2+x+2=24,解得x=4,则R为C,X为Si,T为N,Y为P,Z为S,然后结合元素性质及周期律来解答.
解答:解:由短周期元素R、T、X、Y、Z在元素周期表的相对位置知,R、T应在第二周期,X、Y、Z应在第三周期,设R的最外层电子数为x,则T、Y的最外层电子数为x+1,Z的最外层电子数为x+2,它们的最外层电子数之和为24,则x+x+(x+1)×2+x+2=24,解得x=4,则R为C,X为Si,T为N,Y为P,Z为S,
A.X为Si,位于元素周期表中第三周期第ⅣA族,故A错误;
B.Z为S,其氢化物为H2S,为V型结构,分子中正负电荷中心不重合,属于极性分子,故B正确;
C.Y为P元素,其最高价氧化物对应水化物为磷酸,为中强酸,故C错误;
D.电子层越多,原子半径越大,同周期从左向右原子半径在减小,则五种元素中原子半径最大的是X,故D错误;
故选B.
A.X为Si,位于元素周期表中第三周期第ⅣA族,故A错误;
B.Z为S,其氢化物为H2S,为V型结构,分子中正负电荷中心不重合,属于极性分子,故B正确;
C.Y为P元素,其最高价氧化物对应水化物为磷酸,为中强酸,故C错误;
D.电子层越多,原子半径越大,同周期从左向右原子半径在减小,则五种元素中原子半径最大的是X,故D错误;
故选B.
点评:本题考查位置结构性质的关系及应用,元素的推断为解答的关键,注意利用元素的位置及最外层电子数推断元素,题目难度中等.

练习册系列答案
相关题目
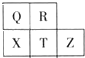 短周期元素R、X、T、Z、Q在元素周期表中的相对位置如图所示,其中T单质和H2在光照的条件下发生爆炸.则下列判断正确的是( )
短周期元素R、X、T、Z、Q在元素周期表中的相对位置如图所示,其中T单质和H2在光照的条件下发生爆炸.则下列判断正确的是( )| A、五种元素中Z的活动性最弱,T 的氧化物对应水化合物酸性最强 | B、氢化物的稳定性:R>Q>X;R>T>X | C、Q单质能从溶液中置换出X单质,R单质能从溶液中置换出T单质 | D、X阴离子和T阴离子相比,半径:X阴离子的大;还原性:T阴离子的强 |
短周期元素R、T、X、Y、Z在元素周期表的相对位置如下表所示,它们的最外层电子数之和为24.则下列判断正确的是( )
| R | T | |
| X | Y | Z |
| A、R位于元素周期表中第二周期第ⅣA族 |
| B、五种元素中原子半径最大的是X |
| C、气态氢化物稳定性:Y>T |
| D、Z元素的最高价氧化物对应的水化物的化学式为HZO4 |