题目内容
【题目】以高纯H2为燃料的质子交换膜燃料电池具有能量效率高、无污染等优点,但燃料中若混有CO将显著缩短电池寿命。
以甲醇为原料制取高纯H2是重要研究方向。甲醇水蒸气重整制氢主要发生以下两个反应:主反应:
CH3OH(g)+H2O(g)=CO2(g)+3H2(g) △H=+49kJmol-1
副反应:H2(g)+CO2(g)=CO(g)+H2O(g) △H=+41kJmol-1
①甲醇蒸气在催化剂作用下裂解可得到H2和CO,则该反应的热化学方程式为__,既能加快反应速率又能提高CH3OH平衡转化率的一种措施是__。
②分析适当增大水醇比![]() 对甲醇水蒸气重整制氢的好处是___。
对甲醇水蒸气重整制氢的好处是___。
③某温度下,将![]() =1∶1的原料气充入恒容密闭容器中,初始压强为P1,反应达平衡时总压强为P2,则平衡时甲醇的转化率为___(忽略副反应)。
=1∶1的原料气充入恒容密闭容器中,初始压强为P1,反应达平衡时总压强为P2,则平衡时甲醇的转化率为___(忽略副反应)。
【答案】CH3OH(g)![]() CO(g)+2H2(g) △H=+90kJ/mol 升温 提高甲醇的利用率,有利于抑制CO的生成或抑制副反应发生 (
CO(g)+2H2(g) △H=+90kJ/mol 升温 提高甲醇的利用率,有利于抑制CO的生成或抑制副反应发生 (![]() -1)×100%
-1)×100%
【解析】
根据盖斯定律计算反应热,根据勒夏特列原理和有效碰撞理论判断平衡正向移动,且增大反应速率的措施;恒温恒容下,气体的压强之比等于其物质的量之比,计算平衡时气体的总物质的量,再利用差量法计算参加反应甲醇的物质的量,进而计算甲醇的转化率。
①甲醇蒸气在催化剂作用下裂解可得到H2和CO,根据盖斯定律,该反应的热化学方程式为CH3OH(g)![]() CO(g)+2H2(g)△H=+49kJmol-1+41kJmol-1=+90kJ/mol,正反应为气体体积增大的吸热反应,升高温度,增大反应速率,有利于平衡正向移动。
CO(g)+2H2(g)△H=+49kJmol-1+41kJmol-1=+90kJ/mol,正反应为气体体积增大的吸热反应,升高温度,增大反应速率,有利于平衡正向移动。
②适当增大水醇比![]() 有利于反应正向进行,提高甲醇的利用率,有利于抑制CO的生成。
有利于反应正向进行,提高甲醇的利用率,有利于抑制CO的生成。
③设起始n(H2O)=n(CH3OH)=1mol,恒温恒容下,气体的压强之比等于其物质的量之比,平衡时气体的总物质的量2mol×![]() ,
,
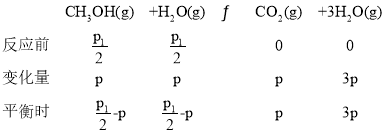
即2mol×![]() =
=![]() -p+
-p+![]() -p+p+3p,p=
-p+p+3p,p=![]() ,故甲醇的转化率为
,故甲醇的转化率为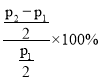 =(
=(![]() -1)×100%。
-1)×100%。