题目内容
新近出版的《前沿科学》杂志刊发的中国环境科学研究院研究员的论文《汽车尾气污染及其危害》,其中系统地阐述了汽车尾气排放对大气环境及人体健康造成的严重危害。目前降低尾气的可行方法是在汽车排气管上安装催化转化器。NO和CO气体均为汽车尾气的成分,这两种气体在催化转换器中发生反应:2CO(g)+2NO(g) N2(g)+2CO2(g) △H=-a kJ·mol-1。
N2(g)+2CO2(g) △H=-a kJ·mol-1。
(1)CO2的电子式为 。
(2)已知2NO(g)+O2(g)=2NO2(g) △H=-b kJ·mol-1;CO的燃烧 热△H=-c kJ·mol-1。书写在消除汽车尾气中NO2的污染时,NO2与CO的可逆反应的热化学反应方程式 。
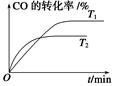
(3)在一定温度下,将2.0mol NO、2.4mol气体CO通入到固定容积为2L的容器中,反应过程中部分物质的浓度变化如图所示:
①有害气体NO的转化率为 ,0~15min NO的平均速率v(NO)= 。
②20min时,若改变反应条件,导致CO浓度减小,则改变的条件可能是 (选填序号)。
a.缩小容器体积 b.增加CO的量 c.降低温度 d.扩大容器体积
③若保持反应体系的温度不变,20min时再向容器中充入NO、N2各0.4mol,化学平衡将 移动(选填“向左”、“向右”或“不”), 移动后在达到平衡时的平衡常数是 。
(1) (1分)
(1分)
(2)4CO(g)+2NO2(g) N2(g)+4CO2(g) △H="-a+b-2c" kJ·mol-1。 (3分,方程式及状态2分,焓变1 分)
N2(g)+4CO2(g) △H="-a+b-2c" kJ·mol-1。 (3分,方程式及状态2分,焓变1 分)
(3)①40% (2分) 0.027mol/(L·min) (2分) ②c d (2分) ③向左 (2分)
5/36 L/mol或0.14 L/mol(2分)
解析试题分析:(1)CO2的电子式  。
。
(2)2CO(g)+2NO(g) N2(g)+2CO2(g) △H=-a kJ·mol-1 ①
N2(g)+2CO2(g) △H=-a kJ·mol-1 ①
2NO(g)+O2(g)=2NO2(g) △H=-b kJ·mol-1 ②
CO(g)+1/2O2(g) CO2(g) △H=-c kJ·mol-1 ③
CO2(g) △H=-c kJ·mol-1 ③
由①-②+2×③得 4CO(g)+2NO2(g) N2(g)+4CO2(g) △H="-a+b-2c" kJ·mol-1。
N2(g)+4CO2(g) △H="-a+b-2c" kJ·mol-1。
(3)①
2CO(g)+2NO(g) N2(g)+2CO2(g)
N2(g)+2CO2(g)
起始浓度(mol·L-1) 1.2 1 0 0
转化浓度(mol·L-1) 0.4 0.4 0.2 0.4
平衡浓度(mol·L-1) 0.8 0.6 0.2 0.4
有害气体NO的转化率为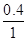 ×100%=40%;0~15min NO的平均速率v(NO)=
×100%=40%;0~15min NO的平均速率v(NO)=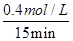 =0.027mol/(L·min)。化学平衡常数K=
=0.027mol/(L·min)。化学平衡常数K=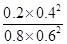 =0.14。
=0.14。
②a.缩小容器体积,CO浓度增大,所以错误。
b.增加CO的量,CO浓度增大,所以错误。
c.降低温度,正向移动,CO浓度减小,所以正确。
d.扩大容器体积,CO浓度减小,所以正确。
所以选c d。
③20min时再向容器中充入NO、N2各0.4mol,此时各成分的浓度变为
2CO(g)+2NO(g) N2(g)+2CO2(g)
N2(g)+2CO2(g)
瞬时浓度(mol·L-1) 0.8 0.6 0.4 0.6
Qc=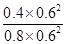 =0.625>0.14,所以逆向移动;化学平衡常数只和温度有关,温度不变,平衡常数不变,所以化学平衡常数还是
=0.625>0.14,所以逆向移动;化学平衡常数只和温度有关,温度不变,平衡常数不变,所以化学平衡常数还是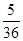 L/mol或0.14 L/mol。
L/mol或0.14 L/mol。
考点:考查化学反应原理综合知识。

碳和碳的化合物广泛的存在于我们的生活中。
(1)根据下列反应的能量变化示意图,2C(s) +O2(g) =2CO(g) △H= 。
(2)在体积为2L的密闭容器中,充人1 mol CO2和3mol H,一定条件下发生反应: CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H<O测得CO2(g)和CH3OH(g)的物质的量随时间变化的曲线如图所示:
CH3OH(g)+H2O(g) △H<O测得CO2(g)和CH3OH(g)的物质的量随时间变化的曲线如图所示: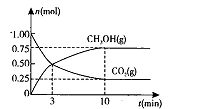
①从反应开始到平衡,H2O的平均反应速率v(H2O)= 。
②下列措施中能使化学平衡向正反应方向移动的是 (填编号)。
A.升高温度 B.将CH3OH(g)及时液化移出
C.选择高效催化剂 D.再充入l mol CO2和4 mol H2
(3)CO2溶于水生成碳酸。已知下列数据:
| 弱电解质 | H2CO3 | NH3.H2O |
| 电离平衡常数( 25℃) | Ka1 = 4.30 × 10一7 Ka2= 5.61× 10一11 | Kb = 1.77× 10一5 |
现有常温下1 mol·L-1的( NH4)2CO3溶液,已知:
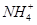 水解的平衡常数Kh=Kw/Kb,
水解的平衡常数Kh=Kw/Kb,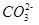
第一步水解的平衡常数Kh=Kw/Ka2。
①判断该溶液呈 (填“酸”、“中”、 “碱”)性,写出该溶液中
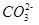 发生第一步水解的离子方程式 。
发生第一步水解的离子方程式 。②下列粒子之间的关系式,其中正确的是 。
A.
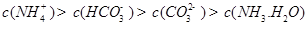
B.

C.
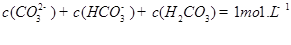
D.
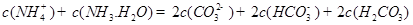
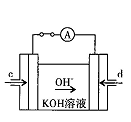
(4)据报道,科学家在实验室已研制出在燃料电池的反应容器中,利用特殊电极材料以CO和O2为原料做成电池。原理如图所示:通入CO的管口是 (填“c”或“d”),写出该电极的电极反应式: 。
合成氯是人类研究的重要课题,目前工业合成氨的原理为:
N2(g)+3H2(g)  2NH3(g) ΔH=-93.0kJ/mol
2NH3(g) ΔH=-93.0kJ/mol
(1)某温度下,在2 L密闭容器中发生上述反应,测得数据如下
| 时间/h 物质的量/mol | 0 | 1 | 2 | 3 | 4 |
| N2 | 2.0 | 1.83 | 1.7 | 1.6 | 1.6 |
| H2 | 6.0 | 5.49 | 5.1 | 4.8 | 4.8 |
| NH3 | 0 | 0.34 | 0.6 | 0.8 | 0.8 |
①0~2 h内,v(N2)= 。
②平衡时,H2的转化率为____;该温度下,反应2NH3(g)
 N2(g)+3H2(g)的平衡常数K= 。
N2(g)+3H2(g)的平衡常数K= 。③若保持温度和体积不变,起始投入的N2、H2、NH3的物质的量分别为a mol、b mol、c mol,达到平衡后,NH3比的浓度与上表中相同的为 (填选项字母)。
A.a=l、b=3.c=0 B.a=4、b=12、c=0
C.a=0、b=0.c=4 D.a=l、b=3、c=2
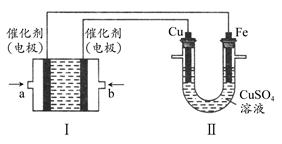
(2)另据报道,常温、常压下,N2在掺有少量氧化铁的二氧化钛催化剂表面能与水发生反应,生成NH3和O2。已知:H2的燃烧热ΔH=-286kJ/mol,则陪制NH3反应的热化学方程式为 。
(3)采用高质子导电性的SCY陶瓷(能传递H'),通过电解法也可合成氨,原理为:
N2(g)+3H2(g)
 2NH3(g)。在电解法合成氨的过程申,应将N2不断地通入 ___极,该电极反应式为 。
2NH3(g)。在电解法合成氨的过程申,应将N2不断地通入 ___极,该电极反应式为 。 根据下列条件计算有关反应的焓变:
(1)已知:Ti(s)+2Cl2(g)=TiCl4(l)ΔH=-804.2 kJ·mol-1
2Na(s)+Cl2(g)=2NaCl(s) ΔH=-882.0 kJ·mol-1
Na(s)=Na(l) ΔH=+2.6 kJ·mol-1
则反应TiCl4(l)+4Na(l)=Ti(s)+4NaCl(s)的ΔH=________ kJ·mol-1。
(2)已知下列反应数值:
| 反应序号 | 化学反应 | 反应热 |
| ① | Fe2O3(s)+3CO(g)= 2Fe(s)+3CO2(g) | ΔH1=-26.7 kJ·mol-1 |
| ② | 3Fe2O3(s)+CO(g)=2Fe3O4(s)+CO2(g) | ΔH2=-50.8 kJ·mol- |
| ③ | Fe3O4(s)+CO(g)=3FeO(s)+CO2(g) | ΔH3=-36.5 kJ·mol-1 |
| ④ | FeO(s)+CO(g)=Fe(s)+CO2(g) | ΔH4 |
则反应④的ΔH4=____________ kJ·mol-1。
 Fe3+(aq)+3OH-(aq) ; ΔH=" a" kJ?mol-1
Fe3+(aq)+3OH-(aq) ; ΔH=" a" kJ?mol-1