题目内容
3.高炉炼铁中发生的基本反应如下:FeO(s)+CO(g)?Fe(s)+CO2(g);△H>0
其平衡常数可表达为:K=$\frac{c(C{O}_{2})}{c(CO)}$,已知1100℃,K=0.263
1100℃时,测得高炉中c(CO2)=0.025mol/L,c(CO)=0.1mol/L,在这种情况下该反应是否处于平衡状态否(填“是”或“否”),此时化学反应向正反应方向进行.
分析 计算此时的浓度商Qc,与平衡常数比较判断反应进行方向.
解答 解:1100℃时,测得高炉中c(CO2)=0.025mol/L,c(CO)=0.1mol/L,此时浓度商Qc=$\frac{c(C{O}_{2})}{c(CO)}$=$\frac{0.025}{0.1}$=0.25,小于平衡常数0.263,故反应不是平衡状态,反应向正反应进行,故答案为:否;正反应.
点评 本题考查利用化学平衡常数分析化学平衡移动,难度中等,侧重对基础知识的巩固与运用,注意掌握化学平衡常数的应用.

练习册系列答案
相关题目
13.X、Y、Z是三种气态物质,在一定温度下其变化符合如图.下列说法一定正确的是( )
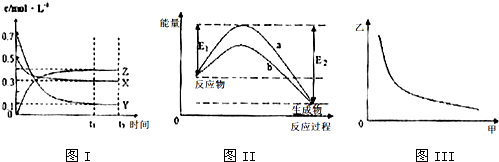

| A. | 该反应热化学方程式为X(g)+3Y(g)?2Z(g)△H=E2-E1 | |
| B. | 若图III中甲表示压强,乙表示Z的含量,则其变化符合图III中曲线 | |
| C. | 该温度下,反应的平衡常数数值约为533.若升高温度,该反应的平衡常数减小,Y的转化率降低 | |
| D. | 图II中曲线b是加入催化剂时的能量变化曲线,曲线a是没有加入催化剂时的能量变化曲线 |
14.碘是一种重要的药用元素,缺乏碘能导致甲状腺肿大等.为预防碘缺乏病,目前我国的家用食盐都是“加碘食盐”.“加碘食盐”中的含碘元素的物质一般是( )
| A. | NaI | B. | KIO3 | C. | I2 | D. | AgI |
11.下列离子反应方程式正确的是( )
| A. | 钠和水的反应:2Na+2H2O═2Na++2OH-+H2↑ | |
| B. | 过氧化钠与水反应:2Na2O2+2H2O═4Na++4OH-+O2↑ | |
| C. | 铁与足量稀盐酸反应:2Fe+6H+═2Fe3++3H2↑ | |
| D. | 碳酸氢钠溶液与烧碱溶液反应:NaHCO3+OH-═Na++CO32-+H2O |
8.已知:某温度下,H2(g)+I2(g)?2HI(g)的平衡常数为K1;$\frac{1}{2}$H2(g)+$\frac{1}{2}$I2(g)?HI(g)的平衡常数为K2,则K1、K2的关系为( )
| A. | K1=2K2 | B. | K1=K22 | C. | K1=K2 | D. | 不能确定 |
15.下列说法正确的是( )
| A. | 碰撞理论认为,反应物分子间必须相互碰撞才有可能发生反应,反应速率的大小与单位时间内反应物分子间有效碰撞的次数成正比 | |
| B. | 电解原理在生产中有着广泛的应用,工业上用电解熔融的氯化钠、氯化镁、氯化铝来冶炼Na、Mg、Al等活泼金属单质 | |
| C. | 盖斯定律表明,一个化学反应的焓变(△H)不仅与反应的起始和最终状态有关,还与反应的途径及过程有关 | |
| D. | 在工业生产中,研制出性能优良的催化剂可以使反应的温度降低,有效提高反应物的转化率,从而起到很好的节能效果 |
7. 五种短周期元素的部分性质数据如下:
五种短周期元素的部分性质数据如下:
(1)Y元素简单阴离子的结构示意图为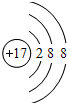 .
.
(2)关于Y、Z两种元素,下列叙述正确的是b(填序号).
a.简单离子的半径:Y>Z
b.气态氢化物的稳定性Y比Z强
c.最高价氧化物对应的水化物的酸性Z比Y强
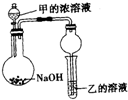
(3)甲是由T、X两种元素形成的10e-分子,乙是由Y、W两种元素形成的化合物.某同学设计了如图所示装置(夹持仪器省)进行实验,将甲的浓溶液滴加到NaOH固体中,烧瓶中即有甲放出,一段时间后,观察到试管中的现象是白色沉淀生成,发生反应的离子方式是Al3++3NH3•H2O=Al(OH)3↓+3NH4+.
(4)XO2是导致光化学烟雾的“罪魁祸首”之一,其被氢氧化钠溶液吸收的化学方程式是:2XO2+2NaOH=M+NaXO3+H2O(已配平),产物M中元素X的化合价为+3.
 五种短周期元素的部分性质数据如下:
五种短周期元素的部分性质数据如下:| 元素代号 | T | X | Y | Z | W |
| 原子半径 (nm) | 0.037 | 0.075 | 0.099 | 0.102 | 0.143 |
| 最高或最低化合价 | +1 | +5,-3 | +7,-1 | +6,-2 | +3 |
 .
.(2)关于Y、Z两种元素,下列叙述正确的是b(填序号).
a.简单离子的半径:Y>Z
b.气态氢化物的稳定性Y比Z强
c.最高价氧化物对应的水化物的酸性Z比Y强
(3)甲是由T、X两种元素形成的10e-分子,乙是由Y、W两种元素形成的化合物.某同学设计了如图所示装置(夹持仪器省)进行实验,将甲的浓溶液滴加到NaOH固体中,烧瓶中即有甲放出,一段时间后,观察到试管中的现象是白色沉淀生成,发生反应的离子方式是Al3++3NH3•H2O=Al(OH)3↓+3NH4+.
(4)XO2是导致光化学烟雾的“罪魁祸首”之一,其被氢氧化钠溶液吸收的化学方程式是:2XO2+2NaOH=M+NaXO3+H2O(已配平),产物M中元素X的化合价为+3.