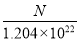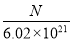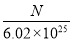题目内容
工业上由废铜屑制硫酸铜晶体的流程如下:

(1)下列溶解铜屑的两种方案中,方案二的优点是 。(答两点即可)
方案一:向铜屑中加入足量的浓硫酸并加热。
方案二:向铜屑中加入少量的银粉再加足量的稀硫酸并通入足量空气。
(2)测定硫酸铜晶体( CuSO4·xH2O)中结晶水数目可通过以下实验步骤确定:
Ⅰ.称取0.4820 g样品置于小烧杯中,加入适量稀硫酸,加热溶解,边搅拌边滴加BaCl2到沉淀完全;
Ⅱ.过滤并洗涤沉淀;
Ⅲ.将盛有沉淀的滤纸包烘干并高温灼烧,再转入高温炉中,一定温度下反复灼烧到恒重,得到BaSO4质量为0.4660 g。
回答下列问题:
①计算CuSO4·xH2O中的x= (要求写出计算过程)。
②步骤Ⅲ中,如果空气不充足和温度过高,可能会有部分沉淀被滤纸中的碳还原为BaS,若其他操作均正确,则x的测定结果将 (填“偏低”、“偏高”或“不变”)。
(1)无需加热、能耗低,无污染性气体SO2 ,耗酸量少或硫酸利用率高(4分答出两点即可,每点2分)
(2)算出SO42-(或BaSO4或CuSO4·xH2O) 为0.002 mol (2分) x = 4.5 (2分)
(3)偏高 (2分)
【解析】
试题分析:(1)方案二的优点是无需加热、能耗低,无污染性气体SO2 ,耗酸量少或硫酸利用率高,形成原电池加快反应速率等;
(2)n(BaSO4)= n(CuSO4)=0.4660÷233=0.002mol,n(H2O)=( 0.4820-0.002×160)÷18=0.009mol ,n(CuSO4):n(H2O)=1:x x = 4.5
若有部分沉淀被滤纸中的碳还原为BaS,则沉淀的质量变少,计算出CuSO4的量变少,水的量偏高,结果偏高。
考点:考查用测定物质组成实验操作及结果分析有关问题。